
(1)已知20.0gNaOH稀溶液跟足量稀盐酸反应,放出28.68kJ热量,那么此反应数据表明:如果NaOH稀溶液跟稀盐酸中和生成18g水时,该反应放出热量_________________kJ,由此测得的中和热为___________kJ/mol
(2)已知断开1 mo![]() lH-H键、1mol Br-Br键、1mol H-Br键分别需要吸收的能量为436kJ、193kJ、366kJ.。 计算H2和Br2反应生成1mol HBr需_______(填“吸收”或“放出”)能量_______kJ。
lH-H键、1mol Br-Br键、1mol H-Br键分别需要吸收的能量为436kJ、193kJ、366kJ.。 计算H2和Br2反应生成1mol HBr需_______(填“吸收”或“放出”)能量_______kJ。
科目:高中化学 来源: 题型:阅读理解
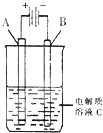 肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.查看答案和解析>>
科目:高中化学 来源: 题型:
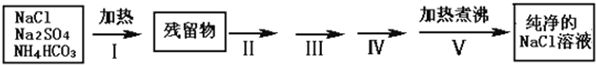
| 操作步骤 | 实验现象 | 实验目的 |
| 步骤II:将残留物溶解得到溶液, |
||
| 步骤III: |
||
| 步骤IV:过滤,往滤液中 |
||
| 步骤V:将溶液加热煮沸 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(12分)工业上可用下列装置来测定黄铁矿中硫的质量分数(忽略SO2、H2SO3与氧气的反应)
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O=2HI+H2SO4
G.吸收液用CCl4萃取,分液
H.取20.00mL吸收液,用标准0.2000mol·L-1的NaOH溶液滴定。
试回答:
(1)已知:4FeS2 + 11 O2 = 2Fe2O3+8SO2 如12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的热化学方程式是 。
(2)步骤G中所用主要仪器是 ,应取 (填“上”或“下” )层溶液进行后续实验。
(3)装置①的作用是 。
(4)步骤H中滴定时应选用 作指示剂
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收。滴定得到的数据如表所示:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.58 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
则硫铁矿样品中硫元素的质量分数为 (保留小数点后1位)
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂 。
A.硝酸银溶液 B.氯化钡溶液 C.澄清石灰水 D.酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省正定中学高二上学期期末考试化学试卷 题型:实验题
(12分)工业上可用下列装置来测定黄铁矿中硫的质量分数(忽略SO2、H2SO3与氧气的反应)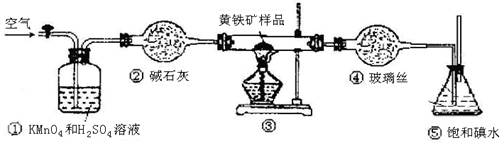
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O=2HI+H2SO4
G.吸收液用CCl4萃取,分液
H.取20.00mL吸收液,用标准0.2000mol·L-1的NaOH溶液滴定。
试回答:
(1)已知:4FeS2 + 11 O2 = 2Fe2O3+ 8SO2 如12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的热化学方程式是 。
(2)步骤G中所用主要仪器是 ,应取 (填“上”或“下” )层溶液进行后续实验。
(3)装置①的作用是 。
(4)步骤H中滴定时应选用 作指示剂
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收。滴定得到的数据如表所示:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.58 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省八市高三3月联考理科综合试卷(化学部分) 题型:选择题
下列依据热化学方程式得出的结论正确的是
A.已知2H2(g) + O2(g) = 2H2O(g)△H =–483.6 kJ·mol–1,则氢气的燃烧热为241.8kJ·mol–1
B.已知C(石墨,s) = C(金刚石,s);△H>0,则金刚石比石墨稳定
C.已知NaOH(aq) + HCl(aq) = NaCl(aq) + H2O(l);△H =–57.4 kJ·mol–1,则含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量
D.已知:2C(s) + 2O2(g) = 2CO2(g);△H1,2C(s) + O2(g) = 2CO(g);△H2则△H1>△H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com