
【题目】
(1)电子工业常用FeCl3溶液做腐蚀液制造印刷电路板。用FeCl3做腐蚀液与Cu反应的原理为:2FeCl3+Cu=2FeCl2+CuCl2将一定量铁粉和铜粉的混合物放入等浓度的FeCl3和CuCl2的混合溶液中,可发生多个反应,其中首先发生反应的离子方程式为:。
(2)某校研究性学习小组用已生锈(Fe2O3)的废铁屑制作印刷电路板的腐蚀液(FeCl3溶液),并将刻蚀电路板后的废液再生为FeCl3溶液循环使用。实验流程如下: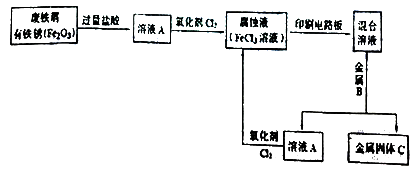
请根据使用流程写出下列反应的离子方程式:
溶液A→腐蚀液:。
混合溶液+金属B→金属固体C:。
(3)检验腐蚀液中Fe3+存在的常用试剂是 , 证明Fe3+存在的现象是。
(4)取适量混合溶液于试管中,加入一定量的铁粉,若反应结束后试管中仍有少量固体,则固体中一定含有 , 溶液中可能含有的金属阳离子是。
【答案】
(1)Fe+2Fe3+=3Fe2+
(2)2Fe2++Cl2=2Fe3++2Cl-;Fe+Cu2+=Cu+ Fe2+
(3)KSCN溶液;呈现血红色
(4)Cu;Cu2+
【解析】(1)由于氧化性Fe3+>Cu2+ , 还原性Fe>Cu,故先发生反应Fe+2Fe3+=3Fe2+;
由流程可知盐酸溶解铁和氧化铁,溶液A中通入氯气将溶液中的氯化亚铁氧化为氯化铁。腐蚀液和铜反应生成氯化铜和氯化亚铁,加入铁粉溶液中的铜离子置换出来,C是铁和铜的混合物。剩余溶液中通入氯气又转化为氯化铁。
(2)根据以上分析可知溶液A→腐蚀液的方程式为2Fe2++Cl2=2Fe3++2Cl-。混合溶液+金属B→金属固体C的方程式为Fe+Cu2+=Cu+ Fe2+ 。
(3)检验腐蚀液中Fe3+存在的常用试剂是KSCN溶液,证明Fe3+存在的现象是溶液呈现血红色。
(4)混合溶液中一定含有氯化铜和氯化亚铁,可能含有氯化铁,因此取适量混合溶液于试管中,加入一定量的铁粉,若反应结束后试管中仍有少量固体,则固体中一定含有铜,溶液中可能含有的金属阳离子是铜离子。
根据铁离子、铜离子的氧化性强弱分析铁和铜在溶液中的反应,结合铁离子的检验方法进行回答即可。


科目:高中化学 来源: 题型:
【题目】石油裂解气用途广泛,由石油裂解气合成生物可降解高聚物J的合成线路如图: 
已知:
i.酯与酯可发生如下酯交换反应:RCOOR'+R″OH ![]() RCOOR″+R'OH ( R、R'、R“代表烃基)
RCOOR″+R'OH ( R、R'、R“代表烃基)
ii.烯烃中,碳碳双键相邻为不稳定结构,碳碳双键易被氧化剂氧化.
(1)A为链状烃,其核磁共振氢谱中有两组峰且面积之比是1:2,则A的名称为 .
(2)B 中所含官能团名称为 .
(3)C→D的反应类型 .
(4)C能与足量的 NaHCO3溶液反应生成C4H2O4Na2 , C的结构简式为 .
(5)D→E的化学方程式是 .
(6)H中不含甲基,H与E形成对称型高聚物J的化学方程式是 .
(7)请完成 B→C 的合理路线 . (无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】槟榔碱在医疗上常用于治疗青光眼,其一种合成路线如图: 
已知:Ⅰ.不饱和化合物与氨(NH3)或胺(R﹣NH2)反应能生成新的胺类化合物
如:R1﹣CH=CH2+R2﹣NH2 ![]() R1﹣CH2﹣CH2﹣NH﹣R2
R1﹣CH2﹣CH2﹣NH﹣R2
Ⅱ. ![]() +R3
+R3![]()
![]()
 +R2OH
+R2OH
(1)B中含氧官能团的名称为 .
(2)反应①的反应类型为;反应②的反应条件为 .
(3)反应③的化学方程式为 .
(4)C的结构简式为 .
(5)下列说法正确的是(填字母). a.反应④为取代反应
b.槟榔碱与化合物G互为同系物
c.1mol D最多能与2mol NaOH发生反应
(6)已知A在NaOH溶液中水解的产物之一是一种新型功能高分子材料(PAANa)的单体,写出生成PAANa的化学方程式 .
(7)已知:CH2=CHCH3+Cl2 ![]() CH2=CHCH2Cl+HCl,以丙烯和乙醇为起始原料,选用必要的无机试剂合成A,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件) .
CH2=CHCH2Cl+HCl,以丙烯和乙醇为起始原料,选用必要的无机试剂合成A,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:用Pt﹣Rh合金催化氧化NH3制NO,其反应的微观模型及含氮生成物产率随反应温度的变化曲线分别如图①、图②所示:下列说法中,不正确的是( ) 
A.400℃时,生成的产物有N2、NO、H2O
B.800℃时,反应的化学方程式是:4NH3+5O2 ![]() ?4NO+6H2O
?4NO+6H2O
C.400℃﹣800℃间,Pt﹣Rh合金对N2的吸附力逐渐减弱
D.800℃以上,发生了反应:2NO(g)?O2(g)+N2(g)△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)硅酸钠的水溶液俗称 , 向碳酸氢钠溶液中滴入1~2滴酚酞溶液,溶液显色。
(2)Fe(OH)3胶体可用作净水剂,取少量Fe(OH)3胶体于试管中,向试管中逐渐滴加稀盐酸至过量,产生的现象为。
(3)实验室盛装NaOH溶液的试剂瓶不能用玻璃塞,以防止发生反应:(离子方程式)。
(4)将Al和Na的单质同时加入到一定量的水中,充分反应后,发现既无沉淀生成又无残留金属存在,请用两个化学反应方程式表示其变化:
①。
②。
(5)已知:5NH4NO3 ![]() 2HNO3+4N2↑+9H2O,则该反应中氧化产物与还原产物的质量比为。
2HNO3+4N2↑+9H2O,则该反应中氧化产物与还原产物的质量比为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月球含有H、He、N 、Na、Mg、Al、Fe、Si等元素,是人类未来的资源宝库,按要求填空。
(1)Na+结构示意图 , 在Na、Al、Fe三种金属元素中,其所形成氧化物种类最多的元素是 , 所形成的氧化物中适宜做耐火材料的元素是;
(2)月球上某矿石经处理得到的MgO中含有SiO2 , 除去SiO2的离子方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验过程如图所示,则图③试管中的现象是( ) 
A.铜片溶解,产生无色气体,该气体遇空气变为红棕色
B.铜片溶解,产生无色气体,该气体遇到空气不变色
C.铜片溶解,放出红棕色有刺激性气味的气体
D.无明显现象,因稀硫酸不与铜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( ) 
A.原NaOH溶液的浓度为0.1mol/L
B.通入CO2的体积为448mL
C.所得溶液的溶质成分的物质的量之比为(NaOH):(Na2CO3)=1:3
D.所得溶液的溶质成分的物质的量之比为(NaHCO3):(Na2CO3)=2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com