
 A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:分析 C核外电子总数是最外层电子数的3倍,应为P元素,C、D为同周期元素,则应为第三周期元素,D元素最外层有一个未成对电子,应为Cl元素,A2-和B+具有相同的电子构型,结合原子序数关系可知A为O元素,B为Na元素.
(1)A为O元素,有O2、O3两种同素异形体,均属于分子晶体,相对原子质量越大,沸点越高;
A、B的氢化物分别为H2O、NaH,前者为分子晶体、后者为离子晶体;
(2)化合物D2A为Cl2O,计算O原子孤电子对数,价层电子对数=δ键数目+孤电子对数,进而确定空间构型;氯气与湿润的Na2CO3反应得到Cl2O,由电子转移守恒可知,先得到HCl生成,HCl再与碳酸钠反应;
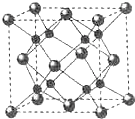
(3)A和B能够形成化合物F为离子化合物,阴离子位于晶胞的定点和面心,阳离子位于晶胞的体心,则Na的个数为8,O的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,N(Na):N(O)=2:1,则形成的化合物为Na2O,由晶胞结构可知B原子配位数为4,结合化学式可以计算A原子配位数,计算质量和体积,可计算密度.
解答 解:C核外电子总数是最外层电子数的3倍,应为P元素,C、D为同周期元素,则应为第三周期元素,D元素最外层有一个未成对电子,应为Cl元素,A2-和B+具有相同的电子构型,结合原子序数关系可知A为O元素,B为Na元素.
(1)A为O元素,有O2、O3两种同素异形体,二者对应的晶体都为分子晶体,因O3相对原子质量较大,则范德华力较大,沸点较高,A的氢化物为H2O,属于分子晶体,B的氢化物为NaH,属于离子晶体,
故答案为:O3;O3相对原子质量较大,范德华力较大;分子晶体;离子晶体
(2)化合物D2A为Cl2O,O为中心原子,形成2个δ键,孤电子对数为$\frac{6-1×2}{2}$=2,则中心原子的价层电子对数为4,立体构型为V形,
氯气与湿润的Na2CO3反应得到Cl2O,由电子转移守恒可知,先得到HCl生成,HCl再与碳酸钠反应,反应的方程式为:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3=Cl2O+CO2+2NaCl),
故答案为:V形;4;2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3=Cl2O+CO2+2NaCl);
(3)A和B能够形成化合物F为离子化合物,阴离子位于晶胞的定点和面心,阳离子位于晶胞的体心,则Na的个数为8,O的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,N(Na):N(O)=2:1,则形成的化合物为Na2O;
由晶胞结构可知B(O)原子配位数为4,结合化学式可知A(Na)原子配位数为4×2=8;
晶胞的质量为$\frac{4×62g/mol}{6.02×1{0}^{23}mo{l}^{-1}}$,晶胞的体积为(0.5×10-7)cm3,则晶体F的密度为$\frac{4×62g/mol}{6.02×1{0}^{23}mo{l}^{-1}}$÷(0.5×10-7)cm3=3.30g•cm-3,
故答案为:Na2O;8;3.30.
点评 本题是对物质结构与性质的考查,涉及沸点比较、空间构型判断、化学方程式书写、晶胞计算等,侧重考查学生的分析能力、计算能力,难度中等.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:解答题
 | 1 | 2 | 3 | 4 |
| V( 样品 ) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(初读数) | 0.00 | 0.50 | 0.70 | 1.00 |
| V(NaOH)(终读数) | 22.60 | 22.25 | 22.05 | 23.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A. | 可与溴水反应,且1 mol该物质与足量溴水反应消耗6 mol Br2 | |
| B. | 可与NaOH溶液反应,1 mol该物质可与5 mol NaOH反应 | |
| C. | 一定条件下1 mol该物质可与H2加成,耗H2最大量为6 mol | |
| D. | 维生素P能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15种 | B. | 28种 | C. | 32种 | D. | 40种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在钠与氯气的反应中,1mol钠失去电子的数目为2NA | |
| B. | 14g氮气所含的氮原子数为NA | |
| C. | 标准状况下,22.4 L水所含的水分子数为NA | |
| D. | 1mol任何物质所含的分子数均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13 | B. | 13 | C. | 11 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 标准状况下,22.4 L己烷中共价键数目为19NA | |
| C. | 1mol羟基与1mol氢氧根离子所含电子数均为9 NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果不正确的是( )
向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果不正确的是( )| A. | 反应过程中,沉淀最多时的质量为78g | |
| B. | 反应过程中,Al3+离子有$\frac{1}{3}$转化为Al(OH)3沉淀,则加入的NaOH溶液的体积可能为3.5L | |
| C. | AlCl3溶液的浓度为2.0 mol/L | |
| D. | 当V(NaOH)=4.0 L时,得到的溶液中Na+、Cl-浓度一定不相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com