
【题目】![]() 的同分异构体中,苯环上的一氯代物只有一种的结构有(不考虑立体异构)( )
的同分异构体中,苯环上的一氯代物只有一种的结构有(不考虑立体异构)( )
A.7种
B.6种
C.5种
D.4种
【答案】D
【解析】解:第一种情况就是四个碳分别形成甲基,
①四个甲基分别连在1、2、3、4位碳原子上,5、6位氢原子等效,苯环上的一氯代物只有一种的结构;
②四个甲基分别连在1、2、4、5位碳原子上,3、6位氢原子等效,苯环上的一氯代物只有一种的结构;
③四个甲基分别连在1、2、3、5位碳原子上,4、6位氢原子等效,苯环上的一氯代物只有一种的结构;
第二种情况就是两个乙基分别为1、4位碳原子上,2、3、5、6位氢原子等效,苯环上的一氯代物只有一种的结构;
所以苯环上的一氯代物只有一种的结构有同分异构体有4种;
故选:D.
根据取代基的种类和个数进行分析,使得有机物结构中含有1种氢原子即可,据此讨论解答.


科目:高中化学 来源: 题型:
【题目】XeO3是一种不稳定的物质,具有强氧化性.
(1)配平反应的离子方程式:
XeO3+Mn2++H2O→MnO4﹣+Xe↑+H+
(2)反应现象为:①有气泡产生;② .
(3)被氧化的元素是 .
(4)将适量的XeO3投入30mL 0.1molL﹣1 Mn2+的水溶液中,刚好完全反应.
①此时转移电子总数为 .
②将反应后的溶液稀释至90mL,所得溶液的pH= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组同学用如图装置进行实验,下列有关说法中,正确的是( ) 
A.若X、Y、Z分别为铁片、铜片、氯化铜溶液,开关K与a连接,则Y极上有气泡放出
B.若X、Y、Z分别为铁片、铜片、氯化铜溶液,开关K与a连接,则溶液中Cu2+向Y极移动
C.若X、Y、Z分别为石墨、石墨、氯化铜溶液,开关K与b连接,则溶液中Cu2+向Y极移动
D.若X、Y、Z分别为石墨、石墨、氯化铜溶液,开关K与b连接,则 Y极上有黄绿色气体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭可以转化为清洁能源和化工原料.
(1)用煤可以制得水煤气.工业上可用煤和水通过水煤气法制氢气,已知下列热化学方程式:
C(s)+ ![]() O2(g)═CO(g)△H1=﹣110.5kJmol﹣1
O2(g)═CO(g)△H1=﹣110.5kJmol﹣1
2H2(g)+O2(g)═2H2O(g)△H2=﹣483.6kJmol﹣1
试求水煤气法制氢气的反应的反应热△H3 .
C(s)+H2O(g)═CO(g)+H2(g)△H3=kJmol﹣1
(2)若H﹣H、O=O和O﹣H键的键能分别是436kJmol﹣1、496kJmol﹣1和m kJmol﹣1 , 结合上述热化学方程式的相关数据计算,m= .
(3)已知一氧化碳与水蒸气反应过程的能量变化如图所示:则此反应为(填“吸热”或“放热”)反应,反应的热化学方程式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将AlCl3溶液和NaAlO2溶液分别蒸发并灼烧,所得产物的主要成份是( )
A.均为Al(OH)3
B.前者得Al2O3,后者得NaAlO2
C.均为Al2O3
D.前者得AlCl3,后者得NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)西班牙的瑞奥汀托河是一条酸河,河水中含有硫酸亚铁和硫酸.经调查发现,这是由于上游河床含有黄铁矿(FeS2 , 铁为+2价),在水中氧的作用下,发生了反应:2FeS2+7O2+2H2O═2FeSO4+2H2SO4 . 反应中FeS2是剂,氧化产物是 , 当有1mol FeS2完全反应时,转移的电子数mol.
(2)某同学打算用稀硫酸与金属锌反应制备标准状况下的氢气224ml,为防止硫酸过量而造成浪费,实验中应需要硫酸mol.
(3)实验室现有一瓶稀硫酸如图A所示,B为空瓶,若利用A瓶中的稀硫酸配制B瓶上标签所示稀硫酸240ml,需要准备的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和 , 所需A瓶中稀硫酸的体积 . 在配制溶液时若实验遇到下列情况,会造成所配硫酸溶液的物质的量浓度偏低的操作是(填序号) . 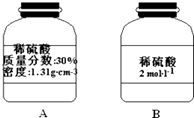
①稀释的硫酸转移到容量瓶中后未洗涤烧杯
②趁热将溶液注入容量瓶中并定容
③摇匀后发现液面低于刻度线于是又加水
④容量瓶中原有少量蒸馏水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计如下装置探究稀盐酸中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu)。恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa'处形成清晰的界面。通电后,可观察到清晰界面缓缓向上移动。下列说法不正确的是( ) 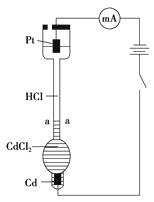
A.通电后,可观察到清晰界面缓缓向上移动的原因是Cd2+向Pt电极迁移的结果
B.装置中Pt电极附近的pH增大
C.一定时间内,如果通过HCl溶液某一界面的总电量为5.0 C,测得H+所迁移的电量为4.1 C,说明该HCl溶液中H+的迁移速率约是Cl-的4.6倍
D.如果电源正负极反接,则下端产生大量Cl2 , 使界面不再清晰,实验失败
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性.
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.2 molL﹣1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 molL﹣1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 molL﹣1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3 . 用离子方程式解释现象Ⅰ: .
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42﹣ , 含有Cu+、Cu2+和SO32﹣ . 已知:Cu+![]() Cu+Cu2+ , Cu2+
Cu+Cu2+ , Cu2+![]() CuI↓(白色)+I2 .
CuI↓(白色)+I2 .
①用稀硫酸证实沉淀中含有Cu+的实验现象是 .
②通过下列实验证实,沉淀中含有Cu2+和SO32﹣ . 
a.白色沉淀A是BaSO4 , 试剂1是 .
b.证实沉淀中含有Cu+和SO32﹣的理由是 .
(3)已知:Al2(SO3)3在水溶液中不存在.经检验,现象Ⅲ的白色沉淀中无SO42﹣ , 该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色.
①推测沉淀中含有亚硫酸根和 .
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.被Al(OH)3所吸附;ii.存在于铝的碱式盐中.对假设ii设计了对比实验,证实了假设ii成立.
a.将对比实验方案补充完整.
步骤一:
步骤二:(按图形式呈现).
b.假设ii成立的实验证据是
(4)根据实验,亚硫酸盐的性质有 . 盐溶液间反应的多样性与有关.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com