
| A. | H3PO3的结构为 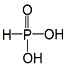 | |
| B. | H3AsO3的结构为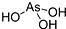 | |
| C. | H3AsO3与H3PO3一样,也为二元酸 | |
| D. | H3AsO3为三元酸,且价层电子对构型为正四面体 |
分析 A.H3PO3为二元酸,含有两个羟基为中强酸;
B.含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,据此确定酸的结构式,H3AsO3为三元酸,含有三个羟基;
C.依据B分析可知,H3AsO3为三元酸;
D.H3AsO3的结构为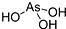 ,是四面体结构不是正四面体结构;
,是四面体结构不是正四面体结构;
解答 解:A.H3PO3为二元酸,含有两个羟基为中强酸,H3PO3的结构为  ,故A正确;
,故A正确;
B.含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,据此确定酸的结构式,H3AsO3为三元酸,含有三个羟基,H3AsO3的结构为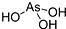 ,故B正确;
,故B正确;
C.依据B分析可知,H3AsO3的结构为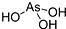 H3AsO3为三元酸,故C错误;
H3AsO3为三元酸,故C错误;
D.H3AsO3的结构为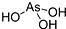 ,是四面体结构不是正四面体结构,故D错误;
,是四面体结构不是正四面体结构,故D错误;
故选CD.
点评 本题考查了酸的结构特征、酸性强弱的分析判断、主要是分子结构的理解应用,掌握基础是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
| 装置 | 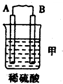 | 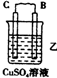 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应是吸热反应 | |
| B. | 断裂1 mol H-H键和1 mol Cl-Cl键时能放出x kJ能量 | |
| C. | 断裂2 mol H-Cl键需要吸收y kJ的能量 | |
| D. | 2 mol HCl(g)的总能量高于1 molH2(g)和1 mol Cl2(g)的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
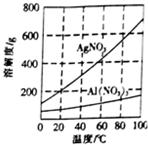 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com