
 铁、铝是现代金属材料的主角.
铁、铝是现代金属材料的主角.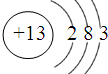

 ,铁能被硝酸氧化为最高价,而过量的铁和三价铁又归中到亚铁离子,故稀硝酸溶液中加入过量铁粉发生反应的离子反应方程式为:3Fe+8H++2NO3-═3Fe2++2NO↑+4 H2O,故答案为:
,铁能被硝酸氧化为最高价,而过量的铁和三价铁又归中到亚铁离子,故稀硝酸溶液中加入过量铁粉发生反应的离子反应方程式为:3Fe+8H++2NO3-═3Fe2++2NO↑+4 H2O,故答案为: ;3Fe+8H++2NO3-═3Fe2++2NO↑+4 H2O;
;3Fe+8H++2NO3-═3Fe2++2NO↑+4 H2O;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:广东省韶关市2011届高三一模理综化学试题 题型:022
铁、铝是现代金属材料的主角.
(1)写出Al的原子结构示意图________;铁在周期表中的位置为________;
(2)已知:铝的燃烧热为1675 kJ·mol-1,2Fe(s)+3/2O2(g) Fe2O3(s);ΔH=-822 kJ·mol-1;
Fe2O3(s);ΔH=-822 kJ·mol-1;
则2Al(s)+Fe2O3(s) Al2O3(s)+2Fe(s);ΔH=________;
Al2O3(s)+2Fe(s);ΔH=________;
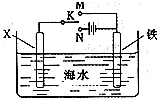
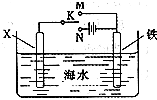
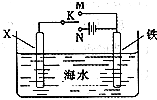
(3)利用下图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于________处(填“M”或“N”).
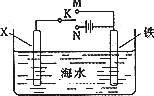
若X为锌,开关K置于M处,则此时铁棒上发生的电极反应方程式为________;
(4)对金属制品进行抗腐蚀处理,可延长其使用寿命.铁制品表面镀铜可防止其腐蚀,电镀时用铜而不用石墨做阳极的原因是________.
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省仪征市高三第一次涂卡训练化学试卷(解析版) 题型:填空题
⑴材料是人类赖以生存和发展的重要物质基础。
①住宅建设需大量的建筑材料,下列物质属于复合材料的是 (填字母)。
a.水泥 b.PVC下水管道 c.玻璃 d.钢筋混凝土
②现代生活离不开金属材料,下列钢铁的防腐方法中,防腐效果最好,但相对费用也最贵的是 (填字母)。
a.涂油漆 b.包塑料层(镀塑) c.制成不锈钢
③废品收购人员发现金属铝做的易拉罐“不生锈”,而铁生锈最厉害,便认为金属铁比铝性质活泼.你认为易拉罐“不生锈”原因是 ;用盐酸可除去铁尺上的铁锈(主要成分为Fe2O3),请您写出除去铁锈的化学方程式 ;
④废旧电池中含有汞,如果随意丢弃,会造成污染,威胁人类健康.汞的元素符号是 ,金属汞在常温下的状态是 。常用的干电池内部填有氯化铵和等物质,在实验室分离氯化铵和二氧化锰混合物,可进行的操作是:溶解、过滤和 ;得到的氯化铵在农业上又可用作 。
⑵2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视。
①汽车上加装尾气催化净化装置可以使NO、CO相互反应转化为空气中含有的两种气体。名称分别为 和 。
②煤燃烧产生的SO2所形成的酸雨中,SO2最终转化成的酸是 (填化学式)。在煤中加入适量石灰石,在氧气的共同作用下,可以与煤燃烧产生的SO2反应生成硫酸钙和二氧化碳气体,发生反应的化学方程式为 。
⑶某种食品的配料标签如图所示。

①该配料中,富含蛋白质的物质是 ,富含油脂的物质是 。
②该配料中的 具有防腐作用。
③请写出检验淀粉的实验方法和现象: 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铝是现代金属材料的主角.
铁、铝是现代金属材料的主角.查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com