
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象 | 结论 |
| A | 把相同大小的一块铝和镁分别投入相同浓度的盐酸中,镁溶解有气泡产生,而铝没有任何变化 | 镁的金属性比铝强 |
| B | 取一块铝箔,用酒精灯点燃,铝箔只熔化成液体 | 铝不易燃烧 |
| C | 向氯化铵溶液中投入一铝片,铝上产生大量气泡 | 该气体是氢气 |
| D | 向氯化铝溶液中逐滴滴加NaOH溶液至过量,先产生沉淀,后沉淀逐渐溶解,最后沉淀完全消失 | 氢氧化铝能溶解于强碱溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 所选装置 | 操作方法 | 实验现象 |
| 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下:| 物质 | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| 溶解度g/100g | 111 | 33.7 | 11.1 | 6.34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 反应在0~10 s内,用Z表示的反应速率为0.158 mol•L-1•s-1 | |
| B. | 反应在0~10 s内,X的物质的量浓度减少了0.79 mol•L-1 | |
| C. | 反应进行到10 s时,Y的转化率为79.0% | |
| D. | 反应的化学方程式为X(g)+Y(g)═Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0表示放热反应,△H<0表示吸热反应 | |
| B. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 | |
| C. | 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 | |
| D. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
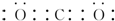
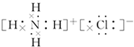

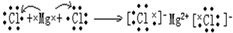 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的颜色不再变化 | |
| B. | 温度和体积一定时,容器内压强不再变化 | |
| C. | 1molH-H键生成的同时有2molH-I键断裂 | |
| D. | 各物质的物质的量浓度之比为2:1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com