
下列四种分离乙醇、乙酸的方案中最佳的一组是( )
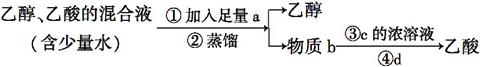
| a | b | c | d | |
| A | Na2CO3饱和溶液 | 乙酸钠 | 硫酸 | 蒸馏 |
| B | Na2CO3固体 | 乙酸钠 | 盐酸 | 过滤 |
| C | CaO固体 | 乙酸钙 | 盐酸 | 过滤 |
| D | CaO固体 | 乙酸钙 | 硫酸 | 蒸馏 |
科目:高中化学 来源: 题型:
某实验需要100 mL 1 mol·L-1的Na2CO3溶液,现通过如下操作配制:
①把称量好的固体Na2CO3放入小烧杯中,加适量蒸馏水溶解。为加快溶解可以使用 (填仪器名称)搅拌。
②把①所得溶液冷却到室温后,小心转入 (填仪器名称)。
③继续加蒸馏水至液面距刻度线1 cm~2 cm处,改用 (填仪器名称)小心滴加蒸馏水至溶液凹液面最低点与刻度线相切。
④用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶塞紧,充分摇匀。
(1)操作步骤正确的顺序是 (填序号)。
(2)若没有操作④,则所配溶液的浓度会_________(填“偏高”或“偏低”)。
(3)在配制100 mL 1 mol·L-1的Na2CO3溶液时,下列操作中的 会导致结果偏低(请用序号填写)。
①用托盘天平称量时砝码放在左盘,并使用了游码
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
③定容时俯视刻度线
④定容时仰视刻度线
⑤干净的容量瓶未经干燥就用于配制溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活、社会密切相关。下列说法不正确的是 ( )
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:NH2COO-+2H2O  HCO3-+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图
HCO3-+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图
所示。以下分析正确的是
A.无法判断T1和T2的大小关系
B.T1 ℃时,第6min反应物转化率为6.25%
C.T2 ℃时,0~6min ν(NH2COO-)=0.3mol·L-1·min-1
D.往平衡体系加水稀释,平衡右移,溶液中各种离子浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列物质中所含少量杂质的方法正确的是( )
| 物质 | 杂质 | 试剂 | 提纯方法 | |
| A | BaSO4 | BaCO3 | 水 | 溶解、过滤、洗涤 |
| B | CO2 | SO2 | 饱和Na2CO3溶液 | 洗气 |
| C | 乙酸乙酯 | 乙酸 | 稀NaOH溶液 | 混合振荡、静置分液 |
| D | 蛋白质 | 葡萄糖 | 浓(NH4)2SO4溶液 | 盐析、过滤、洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、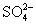 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
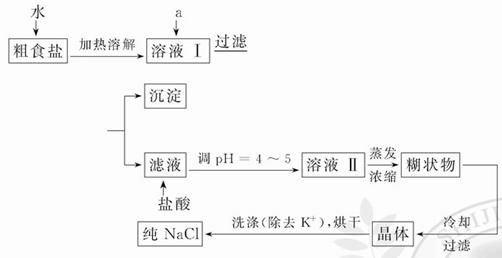
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳 冷水
①欲除去溶液Ⅰ中的Ca2+、Mg2+、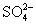 离子,选出a所代表的试剂,按滴加顺序依次为_________________________________________________(只填化学式)。
离子,选出a所代表的试剂,按滴加顺序依次为_________________________________________________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为 ____。
③在整个实验过程中,下列实验装置不可能用到的是 _ (填序号)。

(2)电解饱和食盐水的装置如图所示:
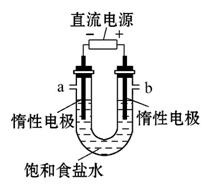
若收集的H2为2 L,则同样条件下收集的Cl2 (填“>”“<”或“=”)2 L,原因是(用化学方程式解释) __________________________。
装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为 。装置b端口出来气体的检验方法是________________
________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下进行性质比较的实验设计,不合理的是( )
A.比较镁、铝金属性:镁、铝(除氧化膜)分别放入4 mol·L-1NaOH溶液中
B.比较氯、溴非金属性:氯气通入溴化钠溶液中
C.比较Cu、Fe2+的还原性:Cu加入FeCl3溶液中
D.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:2SO2(g)+O2(g)  2SO3(g) ΔH=-196 kJ·mol-1。
2SO3(g) ΔH=-196 kJ·mol-1。
(1)该反应的平衡常数表达式为K=________________;某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)________v(逆)(填“<”“>”或“=”)
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
(4)若以如图所示装置,用电化学原理生产硫酸,写出通入SO2电极的电极反应式________________________________________________________________________。
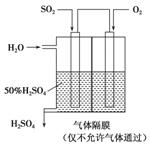
(5)为稳定持续生产,硫酸的浓度应维持不变,则通入SO2和水的质量比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产和生活密切相关,下列说法正确的是( )
A.甘油可用于配制化妆品
B.福尔马林可用于食品、标本、木材等的防腐
C.食品饮料中的菠萝酯,只能从菠萝中提取,不能通过有机合成生产
D.在野外,被黑蚂蚁蜇伤后,涂抹烧碱液可以缓解因注入皮肤内的蚁酸带的疼痛
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com