
【题目】下列关于碱金属的说法中,正确的是( )
A.碱金属单质的密度都比水轻,投入水中都能浮在水面上
B.碱金属单质在氧气中燃烧,产物都是过氧化物
C.碱金属单质的熔沸点一般随着原子的电子层数的增多而升高
D.碱金属单质都是还原剂,其还原性随着核电荷数的增大而增强
科目:高中化学 来源: 题型:
【题目】两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有( )
A.1对
B.2对
C.3对
D.4对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸异戊酯G(![]() )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:
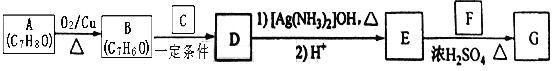
已知以下信息:
①![]() ;
;
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)A的化学名称为_________________ 。
(2)B和C反应生成D的化学方程式为___________________________________ 。
(3)F中含有官能团的名称为____________ 。
(4)E和F反应生成G的化学方程式为__________________,反应类型为_________ 。
(5)F的同分异构体中不能与金属钠反应生成氢气的共有________ 种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3:1的为____________________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蔗糖与浓硫酸的炭化实验会产生大量的有刺激性气味的气体对环境产生污染。为此,某化学兴趣小组设计了如下装置进行实验。玻璃管中①、②、③分别为CO检测试纸 (浸有氯化钯洛液的滤纸,遇CO变黑色)、滴有品红溶液的滤纸、滴有酸性KMn04 溶液的滤纸,a和b分别为两个小气球。

实验步骤如下:按图示连接好仪器,然后检查装置的气密性;装好试剂,夹紧止水夹K,向A瓶中的蔗糖上小心滴加浓硫酸,片刻后可观察到A瓶内蔗糖变黑,体积膨胀,有白雾产生,气球a鼓起,玻璃管中①号滤纸白色变黑色,②号和③号滤纸均褪色。请回答以下问题:
(1)上图中盛有浓硫酸的仪器名称为________。
(2)根据实验中滤纸的现象说明SO2具有的性质分别是:②号_____;③号_____。
A.氧化性 B. 还原性 C. 漂白性 D. 酸性氧化物通性
(3)B瓶中酸性KMnO4溶液的作用是_____________________________________,发生反应的离子方程式为___________________________________________。
(4)打开止水夹K,使气球a内气体缓慢通过B瓶和C瓶,一段时间之后,发现澄清石灰水变浑浊,但此现象并不能证明该反应生成了CO2。为了证明有CO2生成并简化实验装置,可在④号位置放上滴有_____________的滤纸(从以下试剂中选择)。
A.品红溶液 B.酸性高锰酸钾溶液 C.溴水 D.澄清石灰水
(5)若在尾端没有气球b,会有什么不良结果?_____________________________________。
(6)若反应生成的CO2和CO在相同条件下的体积比为2:1,则蔗糖炭化后体积膨胀发生反应的化学方程式可能为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B. NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH-![]() NH3↑+SO32-+2H2O
NH3↑+SO32-+2H2O
C. 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
D. 向FeO中加入稀硫酸:2FeO + 8H+ + SO42- =2Fe3+ + SO2 ↑+ 4H2O
【答案】B
【解析】
Fe(OH)3具有氧化性、I—具有还原性,二者反应生成I2和Fe2+;NaOH溶液电离出的OH-,既与NH4+反应,又与HSO3-反应;酸性条件下溶液中不存在OH-;向FeO中加入稀硫酸,发生复分解反应。
Fe(OH)3具有氧化性、I-具有还原性,二者反应生成I2和Fe2+,离子方程式为2Fe(OH)3+2I-+6H+=2Fe2++6H2O+I2,A错误;NH4HSO3溶液与足量的NaOH溶液混合加热,足量的NaOH溶液电离出的OH-,既与NH4+反应,又与HSO3-反应,方程式符合客观事实,化学式书写正确,电荷和原子都守恒,B正确;酸性条件下KIO3溶液与KI溶液发生反应生成I2,正确的离子方程式为:IO3-+5I-+6H+=3I2+3H2O,C错误;向FeO中加入稀硫酸, FeO与稀硫酸反应生成硫酸亚铁和水,D错误。本题选B。
【点睛】
题考查了离子方程式的书写,明确物质的性质、离子方程式书写规则即可解答,注意掌握离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等。
【题型】单选题
【结束】
19
【题目】为鉴别K2CO3和NaHCO3两种白色固体,有4位同学分别设计了四种不同的方法,其中不可行的是
A. 分别配成1mol/L的溶液,各取1mL滴加1滴酚酞试液,比较颜色深浅
B. 分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
C. 分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀
D. 分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色(必要时可透过蓝色钴玻璃)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A. 金属元素和非金属元素一定形成离子化合物
B. 共价化合物中只有共价键,一定没有离子键
C. 含有金属阳离子的晶体未必是离子晶体
D. 离子化合物中可能含有极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一瓶未知溶液,其中可能含有H+、NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42-、CO32-、Cl-和I-。取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入数滴氯水及2 mL CCl4,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入NaOH 溶液使其变为碱性,无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝;
根据上述实验事实,可知原溶液中肯定含有的离子是_________;肯定没有的离子是_______________。
【答案】H+、Ba2+、I-、NH4+ CO32-、SO42-、Mg2+、Fe3+
【解析】
由(1)知溶液中存在H+离子,无CO32-离子;由(2)知溶液中存在I-离子、无Fe3+离子;由(3)知溶液中无Mg2+离子;由(4)知溶液中有Ba2+离子,无SO42-离子;由(5)知溶液中存在NH4+离子。综上可知溶液中一定含有的离子为H+、NH4+、Ba2+、I-,一定不含有的离子为CO32-、Mg2+、Fe3+、SO42-,可能含有的离子为Na+、K+、Cl-。
【点睛】
本题考查了常见的离子检验方法,涉及的离子之间的反应较多,注意根据有关离子间的反应和现象分析。
【题型】填空题
【结束】
28
【题目】某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
第1组 | 第2组 | 第3组 |
S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示细胞内某些有机物的元素组成和功能的关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位.请回答下列问题:

(1)图中Ⅰ在人体肝脏中是指______________.
(2)图中Ⅱ是__________,使用甲基绿、吡罗红混合染液染色Ⅲ,可使Ⅲ呈现_____色.
(3)图中P一定含有的元素是__________。P的结构通式为_________________
(4)Y和Z彻底水解都可以产生______种物质。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com