
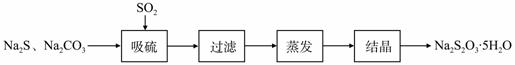
Įņ»Æ¼ī·ØŹĒ¹¤ŅµÉĻÖʱøNa2S2O3µÄ·½·ØÖ®Ņ»£¬·“Ó¦ŌĄķĪŖ£ŗ
2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2 £ØøĆ·“Ó¦”÷H >0£©
>0£©
Ä³ŃŠ¾æŠ”×éŌŚŹµŃéŹŅÓĆĮņ»Æ¼ī·ØÖʱøNa2S2O3”¤5H2OĮ÷³ĢČēĻĀ”£
£Ø1£©ĪüĮņ×°ÖĆČēĶ¼ĖłŹ¾”£
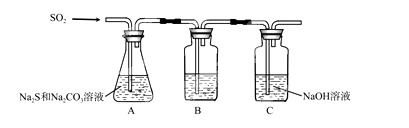
¢Ł×°ÖĆBµÄ×÷ÓĆŹĒ¼ģŃé×°ÖĆAÖŠSO2µÄĪüŹÕŠ§ĀŹ£¬BÖŠŹŌ¼ĮŹĒ £¬±ķĆ÷SO2ĪüŹÕŠ§ĀŹµĶµÄŹµŃéĻÖĻóŹĒBÖŠČÜŅŗ ”£
¢ŚĪŖĮĖŹ¹SO2¾”æÉÄÜĪüŹÕĶźČ«£¬ŌŚ²»øıäAÖŠČÜŅŗÅØ¶Č”¢Ģå»żµÄĢõ¼žĻĀ£¬³żĮĖ¼°Ź±½Į°č·“Ó¦ĪļĶā£¬»¹æɲÉČ”µÄŗĻĄķ“ėŹ©ŹĒ ”¢ ”££ØŠ“³öĮ½Ģõ£©
£Ø2£©¼ŁÉč±¾ŹµŃéĖłÓƵÄNa2CO3ŗ¬ÉŁĮæNaCl”¢NaOH£¬Éč¼ĘŹµŃé·½°ø½ųŠŠ¼ģŃ锣£ØŹŅĪĀŹ±CaCO3±„ŗĶČÜŅŗµÄpH=10.2£©
ĻŽŃ”ŹŌ¼Į¼°ŅĒĘ÷£ŗĻ”ĻõĖį”¢AgNO3ČÜŅŗ”¢CaCl2ČÜŅŗ”¢Ca(NO3)2ČÜŅŗ”¢·ÓĢŖČÜŅŗ”¢ÕōĮóĖ®”¢pH¼Ę”¢ÉÕ±”¢ŹŌ¹Ü”¢µĪ¹Ü
| ŠņŗÅ | ŹµŃé²Ł×÷ | Ō¤ĘŚĻÖĻó | ½įĀŪ |
| ¢Ł | ȔɣĮæѳʷӌŹŌ¹ÜÖŠ£¬¼ÓČėŹŹĮæÕōĮóĖ®£¬³ä·ÖÕńµ“Čܽā£¬___________________”£ | _______________ | ѳʷŗ¬NaCl |
| ¢Ś | ĮķȔɣĮæѳʷӌÉÕ±ÖŠ£¬¼ÓČėŹŹĮæÕōĮóĖ®£¬³ä·Ö½Į°čČܽā£¬___________________”£ | _______________ | ѳʷŗ¬NaOH |
£Ø3£©Na2S2O3ČÜŅŗŹĒ¶ØĮæŹµŃéÖŠµÄ³£ÓĆŹŌ¼Į£¬²ā¶ØĘäÅØ¶ČµÄ¹ż³ĢČēĻĀ£ŗ×¼Č·³ĘČ”a g KIO3£Ø»ÆѧŹ½Įæ£ŗ214£©¹ĢĢåÅä³ÉČÜŅŗ£¬¼ÓČė¹żĮæKI¹ĢĢåŗĶH2SO4ČÜŅŗ£¬µĪ¼ÓÖøŹ¾¼Į£¬ÓĆNa2S2O3ČÜŅŗµĪ¶ØÖĮÖÕµć£¬ĻūŗÄNa2S2O3ČÜŅŗµÄĢå»żĪŖV mL”£Ōņc(Na2S2O3)£½_________mol”¤L£1”££ØÖ»ĮŠ³öĖćŹ½£¬²»×÷ŌĖĖć£©
ŅŃÖŖ£ŗCr2O72££«6I£+14H+=== 2Cr3+£«3I2£«7H2O 2S2O32££«I2===S4O62££«2I£
£Ø14·Ö£©£Ø1£©¢ŁĘ·ŗģ”¢äåĖ®»ņKMnO4ČÜŅŗ £» ČÜŅŗŃÕÉ«ŗÜæģĶŹÉ«»ņÖø³öĻąÓ¦ŹŌ¼ĮµÄÕżČ·ŃÕÉ«£ØŗģÉ«”¢»ĘÉ«µČ£©ŗÜæģĶŹÉ« Ņ²æɵƷ֔£
Ņ²æɵƷ֔£
¢ŚŌö“óSO2µÄ½Ó“„Ć껿”¢æŲÖĘSO2µÄĮ÷ĖŁ”¢ŹŹµ±ÉżøßĪĀ¶Č£Ø“šĘäÖŠ¶žĢõ¼“æÉ£©
£Ø2£©
| ŠņŗÅ | ŹµŃé²Ł×÷ | Ō¤ĘŚĻÖ |
| ¢Ł | µĪ¼Ó×ćĮæĻ”ĻõĖį£¬ŌŁµĪ¼ÓÉŁĮæAgNO3ČÜŅŗ£¬Õńµ“”£ | ÓŠ°×É«³ĮµķÉś³É |
| ¢Ś | ¼ÓČė¹żĮæCaCl2ČÜŅŗ£¬½Į°č£¬¾²ÖĆ£¬ÓĆpH¼Ę²ā¶ØÉĻ²ćĒåŅŗpH | ÓŠ°×É«³ĮµķÉś³É£¬ÉĻ²ćĒåŅŗpH“óÓŚ10.2 |
£Ø3£©6000a/214V »ņ3000a/107V (ĘäĖüÕżČ·“š°øŅ²øų·Ö)



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ(””””)
A. ¦¤H<0”¢¦¤S>0µÄ·“Ó¦ŌŚČĪŗĪĪĀ¶ČĻĀ¶¼ÄÜ×Ō·¢½ųŠŠ
B. NH4HCO3(s) NH3 (g)+H2O(g)+CO2(g)””¦¤H=+185.57 kJ”¤mol-1ÄÜ×Ō·¢½ųŠŠ,ŌŅņŹĒĢåĻµÓŠ×Ō·¢µŲĻņ»ģĀŅ¶ČŌö¼ÓµÄ·½Ļņ×Ŗ±äµÄĒćĻņ
NH3 (g)+H2O(g)+CO2(g)””¦¤H=+185.57 kJ”¤mol-1ÄÜ×Ō·¢½ųŠŠ,ŌŅņŹĒĢåĻµÓŠ×Ō·¢µŲĻņ»ģĀŅ¶ČŌö¼ÓµÄ·½Ļņ×Ŗ±äµÄĒćĻņ
C. ŅņĪŖģŹ±äŗĶģŲ±ä¶¼Óė·“Ó¦µÄ×Ō·¢ŠŌÓŠ¹Ų,Ņņ“ĖģŹ±ä»ņģŲ±ä¾łæÉŅŌµ„¶Ą×÷ĪŖ·“Ó¦×Ō·¢ŠŌµÄÅŠ¾Ż
D. ŌŚĘäĖūĶā½ēĢõ¼ž²»±äµÄĒéæöĻĀ,Ź¹ÓĆ“ß»Æ¼Į,æÉŅŌøıä»Æѧ·“Ó¦½ųŠŠµÄĖŁĀŹ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Ņ»øöĢåÖŲ50kgµÄ½”æµČĖŗ¬FeŌŖĖŲŌ¼2g.Ö÷ŅŖŅŌFe2+”¢Fe3+ŠĪŹ½“ęŌŚÓŚČĖĢåÄŚ.Fe2+Ņ×±»ĪüŹÕ£¬øųʶŃŖÕß²¹³äĢśŹ±£¬Ó¦²¹³äFe2+µÄŃĒĢśŃĪ(ČēFeSO4)”£·žÓĆVitc,æÉŹ¹Ź³ĪļÖŠµÄFe3+×Ŗ»ÆĪŖFe2+.
(1)ČĖĢåÖŠ¾³£½ųŠŠFe2+ 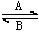 Fe3+µÄ×Ŗ»Æ£¬ŌŚ¹ż³ĢAÖŠ£¬Fe2+×ö ¼Į£¬¹ż³ĢBÖŠFe3+±» .
Fe3+µÄ×Ŗ»Æ£¬ŌŚ¹ż³ĢAÖŠ£¬Fe2+×ö ¼Į£¬¹ż³ĢBÖŠFe3+±» .
(2)VitcŹ¹Fe3+×Ŗ»ÆĪŖFe2+VitcŌŚÕāŅ»¹ż³ĢÖŠ×ö £¬¾ßÓŠ ŠŌ.
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖCo2O3ŌŚĖįŠŌČÜŅŗÖŠŅ×±»»¹Ō³ÉCo2+£»Co2O3”¢Cl2”¢FeCl3”¢I2µÄŃõ»ÆŠŌŅĄ“Ī¼õČõ”£ĻĀĮŠ·“Ó¦ŌŚĖ®ČÜŅŗÖŠ²»æÉÄÜ·¢ÉśµÄŹĒ( )
A. 3Cl2+6FeI2=2FeCl3+4FeI3 B. Cl2+FeI2=FeCl2+I2
C. Co2O3+6HCl=2CoCl2+Cl2ӟ+3H2O D. 2Fe2++ I2=2Fe3++2I-
D. 2Fe2++ I2=2Fe3++2I-
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
½«NaOHČÜŅŗÖšµĪ¼ÓČėNH4HCO3ČÜŅŗÖŠ£ØŗöĀŌČÜŅŗĢå»żµÄ±ä»Æ£©£¬ĻĀĮŠø÷Ź¾ŅāĶ¼±ķŹ¾µÄ»ģŗĻČÜŅŗÓŠ¹ŲĮæµÄ±ä»ÆĒ÷ŹĘÕżČ·µÄŹĒ
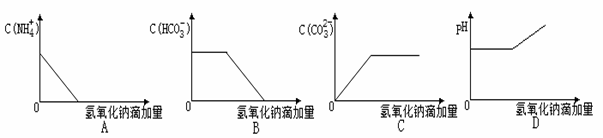
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠ¹ż³ĢŠčŅŖĶصē²ÅÄܽųŠŠµÄŹĒ(””””)
¢ŁµēĄė””¢Śµē¶Ę””¢Ūµē½ā””¢Üµē»ÆѧøÆŹ“””¢ŻĶµÄ¾«Į·
A£®¢Ł¢Ū¢Ü”””” B£®¢Ś¢Ū¢Ż C£®¢Ł¢Ś¢Ū D£®Č«²æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠČČ»Æѧ·½³ĢŹ½ÕżČ·µÄŹĒ£Ø¦¤HµÄ¾ų¶ŌÖµ¾łÕżČ·£© £Ø £©
A£®C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ¦¤H£½+1367.0 kJ”¤ mol-1£ØČ¼ÉÕČČ£©
B£®NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ¦¤H£½+57.3 kJ”¤ mol-1£ØÖŠŗĶČČ£©
C£®S +O2 = = SO2 ¦¤H£½+269.8 kJ”¤ mol-1£Ø·“Ó¦ČČ£©
D£®2H2(g)+ O2(g)===2H2O(l) ¦¤H£½£571.6 kJ”¤ mol-1£Ø·“Ó¦ČČ£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
1gN2ÖŠŗ¬ÓŠxøöŌ×Ó£¬Ōņ°¢·ü¼ÓµĀĀŽ³£ŹżŹĒ
””A£®£Øx/28£©mol-1”””” B£®14x mol-1”” C£®£Øx/14£©mol-1”” D£®28x mol-1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Ķłŗ¬I£ŗĶCl£µÄĻ”ČÜŅŗÖŠµĪČėAgNO3ČÜŅŗ£¬³ĮµķµÄÖŹĮæm(³Įµķ)Óė¼ÓČėAgNO3ČÜŅŗĢå»żV(AgNO3)µÄ¹ŲĻµČēĶ¼ĖłŹ¾”£ŌņŌČÜŅŗÖŠc(I£)/c(Cl£)µÄ±ČÖµĪŖ £Ø £©
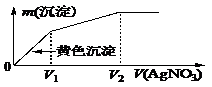
A£®(V2£V1)/V1 B£®V1/V2 C£®V1/(V2£V1) D£®V2/V1
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com