
【题目】实验室合成乙酸乙酯的步骤如下:在圆底烧瓶中加入过量乙醇、浓硫酸和4.5g冰醋酸,再加入2~3片碎瓷片。开始缓慢加热圆底烧瓶,回流50分钟。待反应液冷至室温后,倒入分液漏斗中,依次用水、饱和Na2CO3溶液和水洗涤,分液后的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体。最后进行蒸馏,收集77~78℃馏分,得到乙酸乙酯产品5.28g。
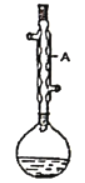
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)仪器A的名称是________
(2)在烧瓶中加入乙醇和浓硫酸的先后顺序是_______
(3)在洗涤操作中,Na2CO3溶液洗涤的主要目的是_______
(4)本实验中,乙酸乙酯产品的产率为_____
【答案】球形冷凝管(或冷凝管) 先加乙醇,后加浓硫酸 去除少量残留的乙酸和乙醇,并降低乙酸乙酯的溶解度以便其充分析出 80% (或0.8)
【解析】
本实验为实验室制备乙酸乙酯的实验,实验原理为:CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O,根据实验仪器结构得出仪器名称,根据乙酸乙酯中混有的杂质分离提纯乙酸乙酯,根据公式:
CH3COOCH2CH3+H2O,根据实验仪器结构得出仪器名称,根据乙酸乙酯中混有的杂质分离提纯乙酸乙酯,根据公式:![]() ,结合反应方程式计算乙酸乙酯产品的产率。
,结合反应方程式计算乙酸乙酯产品的产率。
(1)根据仪器A的结构可知,A为球形冷凝管(或冷凝管);
(2)浓硫酸稀释时放出大量的热,为保证实验安全性,在烧瓶中加入乙醇和浓硫酸的先后顺序是先加乙醇,后加浓硫酸;
(3)在洗涤操作中,Na2CO3溶液可以去除少量残留的乙酸和乙醇,并降低乙酸乙酯的溶解度以便其充分析出;
(4)由题干信息可知,冰醋酸(CH3COOH)的质量为4.5g,物质的量为![]() ,则理论上可以制得乙酸乙酯的物质的量为0.075mol,质量为0.075mol×88g/mol=6.6g,则乙酸乙酯产品的产率=
,则理论上可以制得乙酸乙酯的物质的量为0.075mol,质量为0.075mol×88g/mol=6.6g,则乙酸乙酯产品的产率=![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】"绿色化学"的理想状态是反应物的原子全部转化为目标产物。以下反应不符合绿色化学原则的是
A.工业生产环氧乙烷:2CH2=CH2+O2![]()
![]()
B.水煤气合成甲醇:CO+ 2H2 ![]() CH3OH
CH3OH
C.铝热反应:2Al+ Fe2O3![]() 2Fe + Al2O3
2Fe + Al2O3
D.合成甲基丙烯酸甲酯:![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为: N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1,
I.在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应;
(1)测得反应放出的热量_____92.4kJ (填“小于”,“大于”或“等于”)
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量_____。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_______(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将__________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度______(填“大于”、“小于”或“等于”)原来的2倍。
II.该反应N2(g)+3H2(g)2NH3(g) △H=﹣92.4kJ/mol 在一密闭容器中发生,如图是某一时间段反应速率与反应进程的关系曲线图。
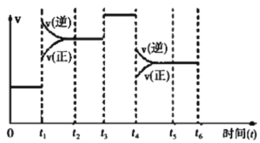
(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1__________,t3__________,t4__________。
(2)下列时间段中,氨的百分含量最高的是_______
A.0~t1B.t2~t3 C.t3~t4D.t4~t5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砂质土壤分析中常用 Karl Fischer法是测定其中微量水含量,该方法是利用I2和SO2反应定量消耗水作为原理(假设土壤中其他成分不参加反应),据此回答下列问题:
(1)写出该反应的化学反应方程式:_______________________。
步骤I:反应样品中的水
下图是某同学在实验室模拟Karl Fischer法的实验装置图:

(2)装置连接的顺序为a→____________(填接口字母顺序);M仪器的名称为________________,其在实验过程中的作用是:____________;
(3)操作步骤为:①连接装置并检查装置气密性,②装入药品,____________________;③关闭弹簧夹,打开分液漏斗活塞;④反应结束后,关闭分液漏斗活塞,继续通入N2,⑤取下D装置,···
步骤④中继续通入N2的目的是________________________________
步骤 II:测定剩余的碘
向反应后的D装置加入蒸馏水,过滤,充分洗涤,并合并洗涤液和滤液,将其配成250.00mL溶液,取25.00mL用0.20mol·L-1 Na2S2O3标准液滴定剩余的I2单质,已知反应如下:2S2O32-+I2=S4O62-+2I-。
(4)Na2S2O3标准液应装在_____________(填“酸式”、“碱式”)滴定管中;上述操作中,合并洗涤液和滤液的目的是__________________________;
(5)滴定实验重复四次得到数据如下:
实验 | ① | ② | ③ | ④ |
消耗的标准液的体积/mL | 18.37 | 20.05 | 19.95 | 20.00 |
①若实验开始时,向D装置中加入10.00 g土壤样品和10.16克I2(已知I2过量),则样品土壤中水的含量为_________%。
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将____________(填“偏高”、“ 偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.将Ca(HCO3)2溶液与少量Ca(OH)2溶液混合:Ca2+ +OH + HCO3 = CaCO3↓+ H2O
B.向Ba(NO3)2溶液中通入SO2气体,出现白色沉淀:SO2+H2O+Ba2+ = BaSO3↓+ 2H+
C.碳酸钙溶于醋酸:CaCO3 + 2H+ = Ca2+ + CO2↑+ H2O
D.往苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O2
+CO2+H2O2![]() +CO32
+CO32
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。其转化关系如图所示,下列判断正确的是( )
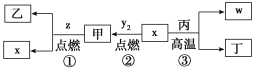
A.反应①、②属于氧化还原反应,③属于非氧化还原反应
B.Y的离子半径比Z的离子半径小
C.反应③可以证明X的非金属性强于W
D.一定条件下,x与甲反应生成丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O(B)Fe +H2SO4= FeSO4 + H2 ↑;根据两反应本质,判断能否设计成原电池A_______B_______(填“能”或“不能”)
(2)根据下图填空

①负极为___________,该电极的方程式为__________________
②正极的现象是________________________________,发生____________________反应(填写“氧化”或“还原”)
③电子从_____经导线流向_______,溶液中H+向________移动(填具体电极材料)。
④若反应过程中有0.1mol电子发生转移,则生成的氢气在标准状况下的体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法错误的是
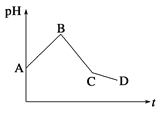
A.阳极先析出Cl2,后析出O2,阴极先产生Cu,后析出H2
B.AB段阳极只产生Cl2,阴极只产生Cu
C.BC段表示在阴极上是H+放电产生了H2
D.CD段相当于电解水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关晶体的叙述中,不正确的是
A. 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B. 12g石墨中含有σ键的个数为2NA (NA表示阿伏伽德罗常数)
C. 氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D. 干冰晶体中,每个CO2分子周围紧邻12个CO2分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com