
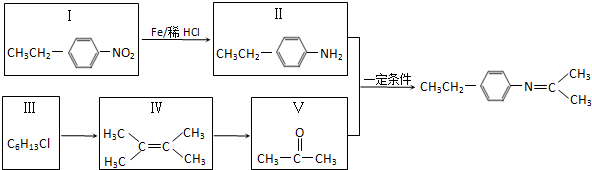
 .
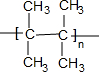
. (写出一种).
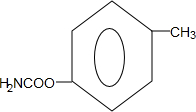
(写出一种).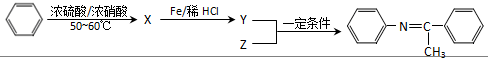
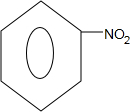 ,Z的结构简式为
,Z的结构简式为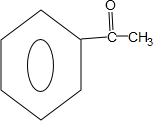 .
. 分析 (1)据Ⅰ的结构简式书写其分子式;Ⅴ的分子式为C3H6O,其完全燃烧生成二氧化碳和水,从其分子中去掉H2O,还有C3H4,按3+$\frac{4}{4}$计算耗氧量;
(2)Ⅲ为卤代烷,在NaOH的水溶液中水解生成醇;
(3)Ⅳ是烯烃,能够发生加聚反应生成高分子化合物;
(4)在酸性条件下发生水解,说明含有酯基,生成物遇FeCl3溶液显紫色,说明生成物含有酚羟基,则其为酚羟基与羧基生成的酯,再据核磁共振氢谱除苯环峰外还有两组峰,峰面积之比为3:2,书写其结构简式;
(5)据Ⅱ与Ⅴ反应生成物的结构简式结合反应条件,判断X与Z的结构简式.
解答 解:(1)据Ⅰ的结构简式可知其分子式为:C8H9NO2,;Ⅴ的分子式为C3H6O,其完全燃烧生成二氧化碳和水,从其分子中去掉H2O,还有C3H4,按3+$\frac{4}{4}$计算1molⅤ完全燃烧耗氧量为4mol,故答案为:C8H9NO2;4;
(2))Ⅲ为卤代烷,在NaOH的水溶液中水解生成醇,反应方程式为:CH3CH(CH3)CCl(CH3)2+NaOH$→_{△}^{水}$CH3CH(CH3)COH(CH3)2+NaCl,
故答案为:CH3CH(CH3)CCl(CH3)2+NaOH$→_{△}^{水}$CH3CH(CH3)COH(CH3)2+NaCl;
(3)Ⅳ是2,2-二甲基-2-丁烯,能够发生加聚反应生成高分子化合物, ,故答案为:
,故答案为: ;
;
(4)在酸性条件下发生水解,说明含有酯基,生成物遇FeCl3溶液显紫色,说明生成物含有酚羟基,则其为酚羟基与羧基生成的酯,再据核磁共振氢谱除苯环峰外还有两组峰,峰面积之比为3:2,其结构简式为: ,或
,或 ,故答案为:
,故答案为: ,或
,或 ;
;
(5)据Ⅱ与Ⅴ反应生成物的结构简式结合反应条件判断X为硝基苯,结构简式为: ,Z为
,Z为 ,
,
故答案为: ;
; .
.
点评 本题考查有机物的推断与合成,注意利用各物质的结构与反应条件进行推断,需要学生熟练掌握官能团的性质与转化,既注重基础知识巩固训练,又较好的考查学生分析推理能力与知识迁移应用,难度中等.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 该物质中不一定含有氧元素 | |
| B. | 该物质的分子组成必须满足n(C)=n(H) | |
| C. | 该物质中一定含有氧元素,且必须满足n(C)=n(O) | |
| D. | 该物质一定不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 1mol贝诺酯分子可与6molH2完全反应 | |
| B. | 可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 | |
| D. | 乙酰水杨酸和对乙酰氨基酚均可与NaHCO3 溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
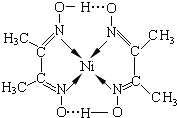 分子内含有的作用力有ACE(填序号).
分子内含有的作用力有ACE(填序号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的CH3COOH溶液中:c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1mol•L的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 0.1mol•L的NH4Cl溶液中:c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 0.1mol•L的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| | X | | Y | |
| R |
| A. | 五种元素中原子半径最大的是W,离子半径最大的是R离子 | |
| B. | X、R、W三种元素的最高价氧化物所对应的水化物的酸性强弱关系为R>W>X | |
| C. | Y与Z形成的化合物一定是碱性氧化物 | |
| D. | Z与W形成的化合物水溶液可能显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入足量BaCl2溶液反应,过滤、洗涤、干燥、恒重,称得固体质量为W1 g | |
| B. | 加入过量的W2 g Zn充分反应后,过滤、洗涤、干燥、恒重,称得固体质量为W3 g | |
| C. | 加入过量的W4 g CaCO3反应停止后,过滤、洗涤、干燥、恒重,称得固体质量为W5 g | |
| D. | 滴入适当指示剂,用已知浓度的NaOH溶液进行滴定,消耗NaOH溶液的体积为V mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA为强酸 | B. | 该混合液pH=7 | ||
| C. | X表示HA,Y表示OH,Z表示H+ | D. | 该混合溶液中:c(A-)+c(Y)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1碳酸钠溶液中的阴离子总数为0.1NA | |
| B. | 将400mL1mol/L的HNO3溶液与7gFe粉充分反应,电子转移数为0.375NA | |
| C. | 标准状况下,14g氦气中共用电子对的数目为1.5NA | |
| D. | 已知反应N2(g)+3H2(g)?2NH3(g)△H=-91.8kJ/mol的转化率为30%,当放出91.8kJ热量时,生成氨分子的数目为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com