
分析 当压强为202KPa时,测得c(A)为1mol/L,当压强增大到303KPa时,如平衡不移动,则c(A)为1.5mol/L,但c(A)为1.2mol/L,说明平衡正向移动,若压强增大到2020KPa,如平衡不移动,则c(A)为10mol/L,而测得c(A)为11mol/L,说明平衡逆向移动,以此解答该题.
解答 解:当压强为202KPa时,测得c(A)为1mol/L,当压强增大到303KPa时,如平衡不移动,则c(A)为1.5mol/L,但c(A)为1.2mol/L,说明平衡正向移动,则a+b>c,若压强增大到2020KPa,如平衡不移动,则c(A)为10mol/L,而测得c(A)为11mol/L,说明平衡逆向移动,则a+b<c,
故答案为:a+b>c;a+b<c.
点评 本题考查化学平衡移动的判断,为高频考点,侧重于学生的分析能力的考查,题目难度中等,注意把握缩小体积气体浓度的变化判断平衡移动的方向,此为解答该题的关键.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 平衡时,其他条件不变,升高温度平衡正向移动 | |
| B. | 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 | |
| C. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 | |
| D. | 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤燃烧时并不能将化学能全部转化为热能 | |
| B. | 原电池将化学能转化为电能 | |
| C. | 二次电池放电时将电能转化为化学能 | |
| D. | 镁条燃烧时将部分化学能转化为光能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为566.0 kJ•mol-1 | |
| B. | 反应②△H<0,所以该反应能自发进行 | |
| C. | 使用催化剂能提高其转化率 | |
| D. | 根据①和②推知总反应为2CO(g)+SO2(g)=S(s)+2CO2 (g)△H=-270kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清的石灰水与稀硝酸反应:OH-+H+═H2O | |
| B. | 氢氧化钡溶液与硫酸的反应:OH${\;}^{{-}^{\;}}$+H+═H2O | |
| C. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 醋酸溶液与碳酸钙反应:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z | W |
| 物质的量/mol | 1.00 | 2.00 | 0 | 2.00 |
| A. | 该可逆反应为反应前后气体体积恒定的反应 | |
| B. | 该可逆反应的正反应为放热反应 | |
| C. | 达到平衡前,反应向逆反应方向进行 | |
| D. | 升高温度,平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
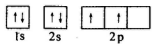 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com