
【题目】将金属M的样品2.5g放入50g 19.6%的硫酸溶液中,恰好完全反应(样品中的杂质既不溶于硫酸,也不与其发生反应),生成硫酸盐。实验测知,此硫酸盐中硫、氧元素的质量分数之和为80 %。试求:
(1)原金属样品中,金属M的质量分数_____
(2)M的相对原子质量__________
(3)反应所得的硫酸盐溶液中溶质的质量分数___________
【答案】96% 24 23%
【解析】
(1)在生成的硫酸盐中,硫、氧元素质量分数之和为80%,则金属M的质量分数为(1—80%)即20%,可以据此解答;
(2)根据金属元素可能的化合价带入进行计算,然后完成解答;
(3)根据(2)的解答求出溶质的质量,然后结合溶质的质量分数的计算公式完成解答即可。
(1)在生成的硫酸盐中,硫、氧元素质量分数之和为80%,则金属M的质量分数为(1—80%)即20%;硫酸盐中的硫、氧元素来自硫酸,故硫、氧元素的质量和为:![]() =9.6g,硫酸盐中金属的质量=
=9.6g,硫酸盐中金属的质量=![]() =2.4g,则样品中金属的质量分数为:
=2.4g,则样品中金属的质量分数为:![]() =96%;
=96%;
(2)根据上述分析可以知道该硫酸盐的相对分子质量为![]() =120,即金属M的相对原子质量=120-96=24;
=120,即金属M的相对原子质量=120-96=24;
讨论:若金属在硫酸盐中呈+1价,则

得金属的相对原子质量A(M)=![]() =12 (不合题意,舍去)。
=12 (不合题意,舍去)。
讨论:若金属在硫酸盐中呈+2价,则
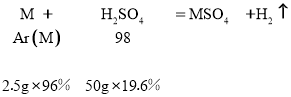
得金属的相对原子质量A(M) =![]() =24,(符合题意)
=24,(符合题意)
讨论:若金属在硫酸盐中呈+3价,则
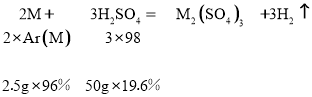
得金属的相对原子质量Ar(M)= ![]() =36(不合题意,舍去)
=36(不合题意,舍去)
(3)设完全反应后,生成硫酸盐的质量为x,生成氢气的质量为y,则
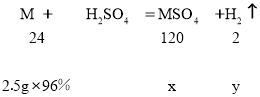
得x=12g ,y=0.2g,所得溶液中溶质的质量分数为:![]() =23%。
=23%。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】![]() 铝土矿
铝土矿![]() 主要成分为
主要成分为![]() ,还含有
,还含有![]() 、
、![]() 是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图:
是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图:
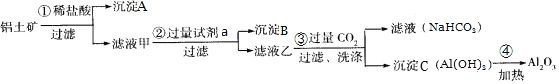
①沉淀A成分是______;步骤![]() 中的试剂a是______;
中的试剂a是______;![]() 以上均填化学式
以上均填化学式![]() ;
;
②简述检验所得滤液甲中存在![]() 的操作方法:______;
的操作方法:______;
![]() 用含少量铁的氧化铜制取氯化铜晶体
用含少量铁的氧化铜制取氯化铜晶体![]() 。有如下操作:
。有如下操作:

已知:在pH为![]() 时,
时,![]() 几乎完全转化为
几乎完全转化为![]() 沉淀,
沉淀,![]() 却不反应。
却不反应。
①氧化剂A可选用______ ![]() 填编号,下同
填编号,下同![]() ;
;
A.![]()
![]()
![]()
![]() 浓盐酸
浓盐酸
②试剂B可选用______;
A.NaOH ![]()
![]()
![]()
③试剂B的作用是______;
A.使![]() 完全沉淀
完全沉淀![]() 使
使![]() 完全沉淀
完全沉淀 ![]() 提高溶液的pH
提高溶液的pH ![]() 除去过量的氧化剂
除去过量的氧化剂
④从滤液经过结晶得到氯化铜晶体的方法是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() ,
,![]() 的反应,一定是自发反应
的反应,一定是自发反应
B.向AgI悬浊液中加人某浓度的KCl溶液,黄色沉淀转化为白色沉淀,说明![]()
C.碘化铅是一种难溶于水的金黄色粉末,常温下碘化铅饱和溶液呈金黄色
D.在相同很度下,HF的![]() 的Ka,则等物质量浓度的NaF与CH3COOK溶液相比较,NaF溶液的pH大于
的Ka,则等物质量浓度的NaF与CH3COOK溶液相比较,NaF溶液的pH大于![]() 溶液的pH
溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2 p1>p2 m+n>p 放热反应B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子化合物A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层结构。请回答:
(1)试写出A的阳离子及阴离子的化学式________、________
(2)适当加热,A就分解为两种气体,其中一种气体是化合物,该反应的化学方程式为________。
(3)A溶于水后生成一种化合物和一种单质,则A的水溶液呈________性(酸/碱/中),原因:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向20.00 mL 0.100 0 mol·L1 CH3COOH中滴加0.100 0 mol·L-1 NaOH过程中,pH变化如图所示。

(1)A点溶液pH > 1,用电离方程式解释原因:___________________。
(2)下列有关B点溶液的说法正确的是_______(填字母序号)。
a.溶质为:CH3COOH、CH3COONa
b.微粒浓度满足:c(Na+) + c(H+) = c(CH3COO-) + c(OH)
c.微粒浓度满足:c(Na+) = c(CH3COOH) + c(CH3COO-)
d.微粒浓度满足:2c(H+) + c(CH3COO-) =2c(OH-) +c(CH3COOH)
(3)C点溶液中离子浓度的大小顺序:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇(C2H5OH)燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。
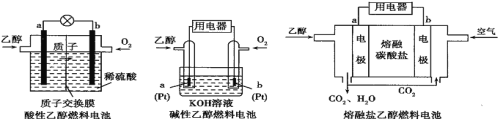
(1)三种乙醇燃料电池中正极反应物均为_________________。(填化学式)
(2)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极___(填“a”或“b”)移动。
(3)酸性乙醇燃料电池中,若电池消耗标准状况下2.24L O2,则电路中通过了的电子数目为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究![]() 与
与![]() 溶液的反应,所用装置如下图所示
溶液的反应,所用装置如下图所示![]() 夹持仪器已略去
夹持仪器已略去![]() 。
。
![]() 实验室配制和保存
实验室配制和保存![]() 溶液应滴加少许______于试剂瓶中。
溶液应滴加少许______于试剂瓶中。
![]() 实验过程中需要配制
实验过程中需要配制![]()
![]() 溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、______。
溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、______。
![]() 该小组同学向5mL
该小组同学向5mL![]()
![]() 溶液中通入足量的
溶液中通入足量的![]() ,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是______。
,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是______。
![]() 该小组同学在
该小组同学在![]() 中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。
中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。
(查阅资料)![]() 离子在溶液中呈红棕色且具有较强的还原性,能被
离子在溶液中呈红棕色且具有较强的还原性,能被![]() 氧化为
氧化为![]() 与
与![]() 溶液反应生成红棕色
溶液反应生成红棕色![]() 离子的离子方程式是______;
离子的离子方程式是______;![]() 与
与![]() 在溶液中反应的离子方程式是______。
在溶液中反应的离子方程式是______。
![]() 为了安全起见,还可以在A、B装置之间加一个______装置。
为了安全起见,还可以在A、B装置之间加一个______装置。
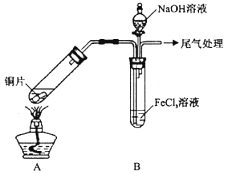
![]() 若实验中用5mL一定浓度的浓
若实验中用5mL一定浓度的浓![]() 与适量Cu片充分反应,实验结束后,测得产生
与适量Cu片充分反应,实验结束后,测得产生![]() 的体积在标准状况下为672mL,向已冷却的A试管溶液中加入
的体积在标准状况下为672mL,向已冷却的A试管溶液中加入![]() 的NaOH溶液30mL时,恰好使
的NaOH溶液30mL时,恰好使![]() 完全沉淀。则所用浓
完全沉淀。则所用浓![]() 浓度为______。
浓度为______。![]() 忽略过程中溶液的体积变化
忽略过程中溶液的体积变化![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42—)在溶液中呈紫红色。
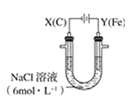
(1)电解过程中,X 极区溶液的 pH__(填“增大”“减小”或“不变”)。
(2)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣=FeO42—+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少__g。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com