
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4∶1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2∶1的离子化合物丙。
(1)D的原子结构示意图为 ________ ,丙的电子式为___________ ,E在周期表中的位置为 。
(2)下列说法正确的有 。
①化合物乙分子中只含有极性共价键
②C、D、E、F原子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物更稳定
④化合物甲和化合物丙都含有离子键和共价键
(3)将F燃烧的产物通入BaCl2和HNO3的混合溶液中,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应 __________________ 。
(4)写出一个由以上元素构成的10电子微粒与18电子微粒反应的离子方程式 ____________________________ 。
(5)甲溶液显 (填“酸性”、“碱性”或“中性”),原因是 (用离子方程式表示)。
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:填空题
有H、D、T三种原子,各自可形成双原子分子H2、D2、T2,请填写下列各题。
(1)标准状况下,它们的密度之比为________。
(2)相同物质的量的三种单质中,质子数之比为________。
(3)各1 g三种单质中,它们的质子数之比为________。
(4)同温同压下,1 L各单质气体中所含电子数之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素周期表的形式多种多样,下图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题: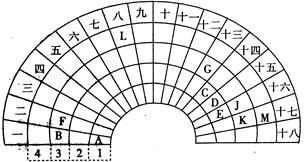
(1)元素C的最高价氧化物的电子式为 ;元素G的离子结构示意图为 。
(2)元素L位于周期表的第 族, 1mol/L LM2溶液500ml与0.4 mol K单质恰好完全反应的离子方程式为_______________________________________。
(3)化合物X是由B、E、G三种元素组成,其水溶液呈_______性,原因是___________
_____________________________________________________(用离子方程式表示)
(4)D和G组成的化合物GD,被大量用于制造电子元件。工业上用G的氧化物、C单质和D单质在高温下制备GD,其中G的氧化物和C单质的则该反应的化学方程式为 。
(5)制取粗硅的过程中,SiO是反应中间产物,隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠)的化学方程式______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为部分短周期元素化合价及相应原子半径的数据:
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.077 |
| 最高化合价 | +6 | +5 | +4 | | +5 | | +7 | +4 |
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
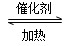 2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3∶1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)B与D形成的非极性分子中中心原子的孤对电子数是________,中心原子的杂化轨道类型为________。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是____________(写分子式),它们的稳定性由弱到强的顺序是_______________________________________________________(写分子式)。
(3)分子ABC、BA2D的空间构型分别是________、________。
(4)B、C、D三种元素的电负性由大到小的顺序是________(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
(5)C的单质分子中存在________个π键、________个σ键。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素X、Y、Z、W的原子序数依次增大。X的氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与主族序数相等;Z的单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。
请回答下列问题:
(1)Y在元素周期表中的位置是________;X的氢化物的电子式是________。
(2)X的氢化物的水溶液与W的氢化物的水溶液混合后恰好反应时,溶液呈________(填“酸”、“碱”或“中”)性,用离子方程式表示其原因:____________________。
(3)Z和W比较,非金属性较弱的是________(填元素符号),下列可以验证这一结论的是________(填序号)。
a.元素在地壳中的含量
b.氧化物对应水化物的酸性
c.断开氢化物中1 mol H—Z或H—W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
(4)含Y的两种盐溶液混合产生白色沉淀,写出反应的离子方程式:______________________________________________________。
(5)X、Z、W的最高价氧化物对应的水化物的酸性强弱顺序为________(用化学式表示,下同);Z、W的简单气态氢化物的还原性强弱顺序为________;X、Z、W的最简单氢化物中,沸点最高的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A、B、C、D分别是由短周期元素组成的四种微粒,它们之间有如图所示的转化关系,且A是一种含有18电子的微粒,C是一种含有10电子的微粒。请回答下列
问题:
(1)若A、D分别是两种气态单质分子,写出A与B反应的化学方程式:_____________________________________________________。
(2)若B、D属于同主族元素形成的单质分子,写出C的化学式:________。
(3)若A、B均是含有2个原子核的微粒,且B中含有10个电子,D中含有18个电子,则A、B之间发生反应的离子方程式为_____________________。
(4)若D是一种含有22电子的分子,则符合如图所示转化关系的A为__________(写出物质的化学式,如果是有机物则写出相应的结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙、丙、丁、戊、己为原子序数依次增大的短周期主族元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,乙元素最高化合价与最低价的代数和为0;丙、丁、戊的最高价氧化物的水化物之间都能发生反应。用化学用语回答下列问题:
(1)甲的阴离子的结构示意图为 ;用电子式表示乙与戊形成化合物的过程 。
(2)丙、丁、戊的离子半径由大到小的顺序为 ;乙、戊、己的氢化物的还原性最弱的是 。
(3)写出由甲乙两元素形成的化合物中,既含有极性键又含有非极性键,且相对分子质量最小的物质的结构式 ;该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为 。
(4)丙、丁的最高价氧化物的水化物之间发生反应的离子方程式为 。由甲、丙、戊、己中部分元素形成的两种化合物的水溶液之间可以发生反应,该化学方程式为: 。
(5)按下图电解丙和己形成化合物的饱和溶液,该装置可用于家庭用水的消毒。写出该电解池中发生反应的总反应方程式: 。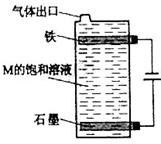
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有A、B、C、D四种短周期元素,已知A、B同主族,B、C、D同周期,A、B的原子序数之和等于C、D的原子序数之和,C的单质能分别跟B和D的最高价氧化物的水化物反应。请回答:
(1)B和C的元素符号分别为_____________________
(2)上述四种元素的原子半径由大到小的顺序为__________________(用元素符号表示)
(3)D单质在A单质中燃烧的产物与二氧化碳反应的化学方程式为_____________________
(4)B单质能跟D的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种盐的水溶液均呈碱性,该氧化还原反应的离子方程式为_____________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com