
| A. | 用乙醇萃取溴水中的溴单质可选用分液漏斗 | |
| B. | 为了保证冷凝效果,蒸馏操作时冷凝水流向要与蒸馏水流动方向相同 | |
| C. | 蒸馏操作时温度计的水银球要与圆底烧瓶的支管口相平 | |
| D. | 分液时,需将分液漏斗上口的塞子打开或使玻璃凹槽和小孔连通 |
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 使酚酞试液变红的溶液中:Na+、HCO3-、NO3-、SiO32- | |
| B. | 某透明溶液中:Fe3+、K+、NO3-、Cl- | |
| C. | 某溶液中加入金属铝有氢气放出:K+、Ba2+、Cl-、SiO32- | |
| D. | 某无色溶液中:K+、Al3+、AlO2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 冰水混合物 | CuSO4•5H2O | 液态 KNO3 | 蔗糖 |
| B | CaO溶液 | 海水 | 铜 | 酒精 |
| C | 氯气 | 铝合金 | AgCl | CO2 |
| D | 氢氧化钠 | 空气 | Na2SO4溶液 | 食醋 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖溶液不能导电,故蔗糖溶液时非电解质 | |
| B. | AgCl难溶于水,属于电解质 | |
| C. | SO3溶于水形成的溶液能导电,所以SO3是电解质 | |
| D. | 纯水的导电性很差,所以水不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO | B. | Fe2O3 | C. | CuO | D. | Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
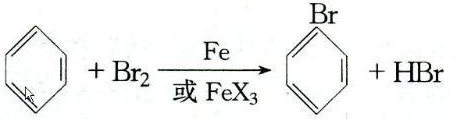 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
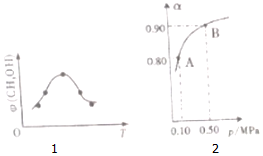 科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:CO(g)+2H2(g)→CH3OH(g)+H2O(g)△H
科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:CO(g)+2H2(g)→CH3OH(g)+H2O(g)△H查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com