
| A. | 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 | |
| B. | SO2具有漂白性,可使紫色石蕊试液褪为无色 | |
| C. | 丁达尔效应是区分胶体和溶液的一种常用物理方法 | |
| D. | 在实验室里,常用电解饱和食盐水的方法制取氯气 |
分析 A、氯化钠溶液与铝制容器可以构成原电池,金属铝作负极,发生电化学腐蚀;
B、二氧化硫不能是石蕊褪色;
C、胶体有丁达尔效应,但溶液没有;
D、实验室中制取氯气采用浓盐酸和二氧化锰的反应.
解答 解:A、氯化钠溶液与铝制容器可以构成原电池,金属铝作负极,发生电化学腐蚀,加快铝腐蚀,故A错误;
B、二氧化硫不能是石蕊褪色,只能使紫色石蕊溶液变红,而不能褪色,故B错误;
C、胶体有丁达尔效应,但溶液没有,且丁达尔效应是物理性质,故可以用于区分溶液和胶体,故C正确;
D、实验室中采用浓盐酸和二氧化锰反应制取氯气,不用电解饱和食盐水的方法,故D错误.
故选C.
点评 本题考查了氯气的实验室制法、二氧化硫漂白性的体现以及溶液和胶体的鉴别等,难度不大,注意一种物质的实验室制法通常是固定的.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
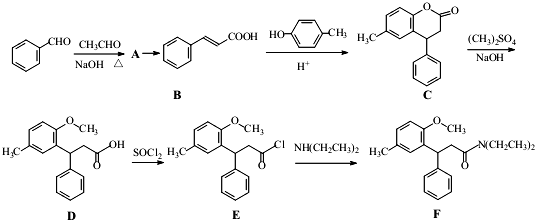
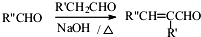
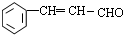 .
.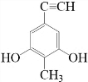 (或
(或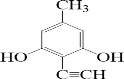 、
、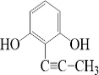 、
、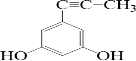 );.(任写一种)
);.(任写一种)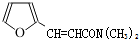 )是一种高效麻醉剂,写出以
)是一种高效麻醉剂,写出以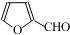 、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂自选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CHCH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂自选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CHCH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
| 放出气体的体积(mL) | 2240 | 4480 | 6720 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
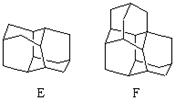 在石油中存在一种有机分子(D),X-射线衍射技术测得其结构高度对称,分子中碳原子的排列方式相当于金刚石晶胞中的部分碳原子排列,故D俗称金刚烷.图给出两种由2,3个D为基本结构单元“模块”像搭积木一样“搭”成的较复杂笼状烷的结构式.金刚烷(D)的结构式为
在石油中存在一种有机分子(D),X-射线衍射技术测得其结构高度对称,分子中碳原子的排列方式相当于金刚石晶胞中的部分碳原子排列,故D俗称金刚烷.图给出两种由2,3个D为基本结构单元“模块”像搭积木一样“搭”成的较复杂笼状烷的结构式.金刚烷(D)的结构式为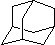 ,其中碳原子的杂化方式为sp3杂化,E的分子式为C14H20.在星际云中也发现一种高度对称的有机分子,分子式为(CH2)6N4,结构类似于金刚烷,俗称四氮金刚烷,它和金刚烷互为C(填标号).
,其中碳原子的杂化方式为sp3杂化,E的分子式为C14H20.在星际云中也发现一种高度对称的有机分子,分子式为(CH2)6N4,结构类似于金刚烷,俗称四氮金刚烷,它和金刚烷互为C(填标号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
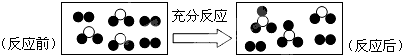
| A. | 一定属于可逆反应 | B. | 一定属于化合反应 | ||
| C. | 一定属于氧化还原反应 | D. | 一定属于吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
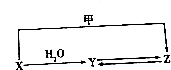 有机物X、Y、Z的转化关系如图所示(化学反应条件已省略),又己知X的储量是衡量一个国家石油化工发展水平的标志,甲是空气的主要成分之一,Y是一种常用的液体燃料.
有机物X、Y、Z的转化关系如图所示(化学反应条件已省略),又己知X的储量是衡量一个国家石油化工发展水平的标志,甲是空气的主要成分之一,Y是一种常用的液体燃料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com