
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+═Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol.下列说法正确的是( )
|
| A. | 反应中硫元素被氧化,所有铁元素均被还原 |
|
| B. | 氧化剂是Fe3+,氧化产物是Cu2+ |
|
| C. | 反应中转移电子的物质的量为xmol |
|
| D. | 反应结束后,测得溶液中三种金属离子的总物质的量为ymol,则原Fe3+的总物质的量为(y﹣x)mol |
| 氧化还原反应的计算.. | |
| 专题: | 氧化还原反应专题. |
| 分析: | CuFeS2+4Fe3+=Cu2++5Fe2++2S中,S元素的化合价由﹣2价升高为0,Fe元素的化合价由+3价降低为+2价,反应中Fe3+为氧化剂,CuFeS2为还原剂,结合元素化合价的变化解答该题. |
| 解答: | 解:A.反应中硫元素被氧化,但只有铁离子中的铁元素被还原,故A错误; B.氧化剂是Fe3+,氧化产物是S,故B错误; C.由离子方程式可知生成2molS,转移电子4mol,则生成xmolS,则转移2xmol电子,故C错误; D.由方程式可知,生成xmol硫,则生成3xmol金属离子,消耗2xmolFe3+,反应结束后,测得溶液中三种金属离子的总物质的量为ymol,则剩余Fe3+的物质的量为(y﹣3x)mol,所以原Fe3+的总物质的量为2xmol+(y﹣3x)mol=(y﹣x)mol,故D正确. 故选D. |
| 点评: | 本题考查氧化还原反应的计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意从元素化合价的角度认识,难度不大. |


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
空对空“响尾蛇”导弹头部的“红外眼睛”,能分辨出0.001 ℃的温差变化,它是由热敏陶瓷材料和热释电陶瓷材料做成的。下列叙述中不正确的是( )
A.“红外眼睛”对热非常敏感
B.“红外眼睛”的热目标是敌机发动机或尾部喷口高温区
C.“红外眼睛”的电阻值随温度明显变化
D.“红外眼睛”的工作原理与人眼相同
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应实验,设计正确且能达到实验目的的是( )
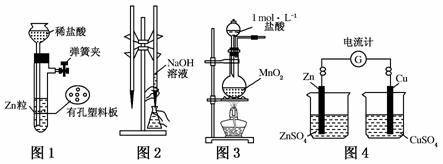
A.用图1所示装置制取少量H2
B.用图2所示装置进行用已知浓度的氢氧化钠溶液测定盐酸的浓度的实验
C.用图3所示装置制取少量Cl2
D.用图4所示装置确定导线中有电流通过及电流方向
查看答案和解析>>
科目:高中化学 来源: 题型:
将二氧化硫通入溴水中发生如下的反应:SO2+Br2+2H2O═2HBr+H2SO4,反应中转移的电子数和还原剂是( )
|
| A. | 2e﹣,H2SO4 | B. | 4e﹣,SO2 | C. | 2e﹣,Br2 | D. | 2e﹣,SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 将Cl2通人FeBr2溶液中,溶液颜色变黄,则Fe2+被氧化,Br﹣不一定参加了反应 |
|
| B. | CO2、SO3、NO2和水反应均能生成酸,都属于酸性氧化物 |
|
| C. | 0.5 mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量.其燃烧热的热化学方程式为CH4 (g)+2O2(g)=CO2(g)+2H2O(g)△H=﹣890kJ/mol |
|
| D. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
|
| A. | 9.0 L | B. | 13.5 L | C. | 15.7 L | D. | 16.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
“封管实验”具有简易、方便、节约、绿色等优点。观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
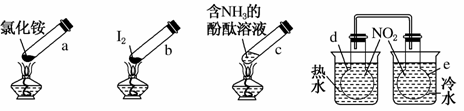
A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳性比较好
B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体
C.加热时,c中溶液红色变深,冷却后又变浅
D.水浴时,d内气体颜色变浅,e内气体颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
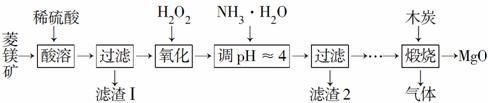
(1)MgCO3与稀硫酸反应的离子方程式为___________________ _____________________________________________________________________________________________________________________________。
(2)加入H2O2氧化时,发生反应的化学方程式为________________________________________________________________________________________________________________________________________________。
(3)滤渣2的成分是____________________________________________ _________________________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C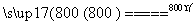 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C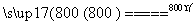 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C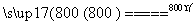 MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集。
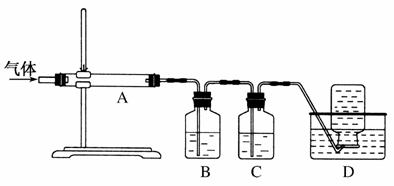
①D中收集的气体是________(填化学式)。
②B中盛放的溶液可以是________(填字母)。
a.NaOH溶液 b.Na2CO3溶液
c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式:
___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1) 鉴别NaCl和Na2CO3溶液的试剂是 ,离子方程式为 。
(2) 除去混入Na2CO3溶液中少量NaHCO3杂质的试剂是 ,离子方程式为
。
(3) 除去Fe粉中少量Al粉杂质的试剂是 ,离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com