
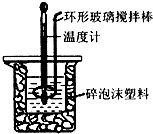
 用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
分析 (1)依据量取溶液的体积选择合适的量筒;
(2)中和热测定实验成败的关键是减少热量的损失;
(3)中和热的测定中,完全反应后混合溶液的最高温度为终止温度;
(4)先判断数据的有效性,然后计算出平均温度差,再根据Q=m•c•△T计算反应放出的热量;
(5)根据弱电解质电离吸热分析.
解答 解:(1)在该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪是50ml量筒和胶头滴管;
故答案为:50ml量筒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失;
故答案为:减少实验过程中的热量损失;
(3)中和热的测定中,完全反应后混合溶液的最高温度为终止温度;
故答案为:混合溶液的最高;
(4)第三次得到温度差误差较大,应该舍弃,所以平均温度差为:$\frac{3.25℃+3.15℃}{2}$=3.2℃,溶液的质量为:100ml×1g/ml=100g,则该反应中放出的热量为:Q=m•c•△T=100g×4.18J/(g•℃)×3.2℃=1340J;
故答案为:1340;
(5)一水合氨为弱碱,电离过程为吸热过程,放出的热量偏少,但中和热△H为负值,用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热偏大;
故答案为:偏大;一水合氨为弱电解质,反应过程中电离需要吸收热量,故放出的热量偏少,△H偏大;
点评 本题考查了中和热的测定,明确中和热的测定步骤为解答关键,注意掌握中和热计算方法,试题培养了学生的分析能力及化学实验能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 元素周期表揭示了化学元素间的内在联系,是化学发展史上重要里程碑 | |
| B. | 在周期表中,把电子层数相同的元素排成一横行,称为一周期 | |
| C. | 元素周期表中,总共有18个纵行,18个族,IIIB族含有32种金属元素 | |
| D. | 第IA族(除H)元素又称为碱金属元素,第ⅦA族元素又称为卤族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性 Z>Y>X | B. | 原子半径 X>Y>Z | ||
| C. | 气态氢化物的稳定性 X>Y>Z | D. | 原子最外层电子数Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; 的系统名称为:3,4,4一三甲基一l一戊炔
的系统名称为:3,4,4一三甲基一l一戊炔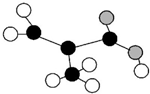 所示(图中球与球之间的连线代表化学键,如单键、双键等).该分子的结构简式为
所示(图中球与球之间的连线代表化学键,如单键、双键等).该分子的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
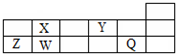
| A. | W、X两元素在自然界中都存在相应的单质 | |
| B. | Q、Y分别与钠元素形成的化合物中仅含离子键 | |
| C. | 简单离子半径由大到小的顺序为:Q>Y>Z | |
| D. | X、Z的最高价氧化物对应的水化物之间易发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的还原性:K>Na>Mg>Al | |
| B. | 氢化物的稳定性:HCl<H2S<PH3<SiH4 | |
| C. | 酸性:H2CO3<H3PO4<H2SO4<HClO4 | |
| D. | 原子的氧化性:F>Cl>S>P |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质属于氧化物 | |
| B. | 乙酸与乙醇反应生成乙酸乙酯属于取代反应 | |
| C. | 该物质的相对分子质量为88 | |
| D. | 乙酸乙酯燃烧有二氧化碳和水生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com