
| A. | 铁杵成针 | B. | 抱薪救火 | C. | 闭门造车 | D. | 刻舟求剑 |
 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:解答题
| 应称取氢氧化钠固体的质量/g | 应选用容量瓶的规格/mL | 除烧杯、托盘天平、容量瓶、量筒外还需的其它仪器 |
| 10.0 | 250 | 玻璃棒、胶头滴管、药匙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片跟氢氧化钠溶液反应 6H2O+2Al+2OH?═2[Al(OH)4]-+3H2↑ | |
| B. | 明矾溶液中加入过量的氨水 Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| C. | 碳酸氢钙溶液中加入过量的氢氧化钠溶液 HCO3-+OH-═CO32-+2H2O | |
| D. | 铜片跟稀硝酸反应 Cu+NO3-+4H+═Cu2++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 等量H2在O2中完全燃烧,生成H2O(g)与生成H2O(1)放出的能量相同 | |
| C. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | |
| D. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的硫酸溶液时,只需使用1次玻璃棒 | |
| B. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体时即停止加热 | |
| C. | 液溴盛放在用水液封的棕色试剂瓶中 | |
| D. | 用四氯化碳萃取碘的饱和水溶液中的碘.分液时显紫红色液体在下层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3在反应中被还原 | |
| B. | 被还原与被氧化的氧元素的质量比为1:5 | |
| C. | H204在反应中既没被氧化也没被还原 | |
| D. | 生成1mol Cl2时有2mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
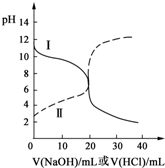 25℃时取浓度均为0.1000mol•L-1的CH3COOH(aq)和氨水各20mL,分别用0.1000mol•L-1NaOH(aq)、0.1000mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25℃时取浓度均为0.1000mol•L-1的CH3COOH(aq)和氨水各20mL,分别用0.1000mol•L-1NaOH(aq)、0.1000mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A. | 曲线Ⅰ:滴加溶液到10.00mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 曲线Ⅱ:滴加溶液到10.00mL时:c(CH3COO-)-c(CH3COOH)=2[c(OH-)-c(H+)] | |
| C. | 曲线Ⅱ:滴加溶液在10.00mL~20.00mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| D. | 曲线Ⅰ:滴加溶液到20.00mL时,c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com