
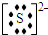
 ;B-的核内质子数=核外电子数-电荷数=18-1=17,则该元素是Cl元素,则Cl-的原子结构示意图为
;B-的核内质子数=核外电子数-电荷数=18-1=17,则该元素是Cl元素,则Cl-的原子结构示意图为 ;
; ;
; ;
; ,
, ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、 说明烯烃与H2的加成反应是放热反应,虚线表示在有催化剂的条件下表示 |
B、 用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,曲线可确定①的酸性最强 |
C、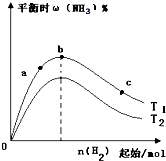 表示合成氨反应在其他条件不变的情况下,改变起始n(H2)对平衡的影响.由此可知,N2转化率最高的是b点;且T1>T2,K2>K1(T1和T2 表示温度,K1、K2表示对应温度下的平衡常数) |
D、 表示可逆反应“A2(g)+3B2 (g)?2AB3(g)”△H小于0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:
如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(CH3OH) |
| n(CO2) |
| 序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com