
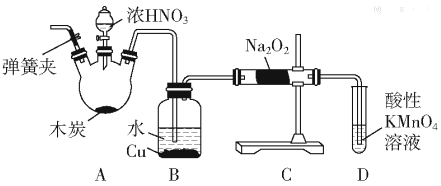
【题目】亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示:
已知:室温下,①2NO+Na2O2=2NaNO2;
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+。
请按要求回答下列问题:
(1)检査完该装置的气密性,装入药品后,实验开始前通入一段时间气体Ar,然后关闭弹簧夹,再滴加浓硝酸,加热控制B中导管均匀地产生气泡。上述操作的作用是___。
(2)B中观察到的主要现象是___;
(3)A装置中反应的化学方程式为___;
(4)D装置中反应的离子方程式___;
(5)预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和___。为避免产生这些副产物,应在B、C装置间增加装置E,则E中盛放的试剂名称为___。
(6)利用改进后的装置,将3.12gNa2O2完全转化成为NaNO2,理论上至少需要木炭___g。
【答案】排尽空气,防止生成的NO被O2氧化 红棕色气体消失,铜片溶解,溶液变蓝,导管口有无色气泡冒出 C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O 3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O NaOH 碱石灰 0.48
CO2↑+4NO2↑+2H2O 3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O NaOH 碱石灰 0.48
【解析】
A中浓硝酸和碳在加热的条件下发生反应生成二氧化氮、二氧化碳和水,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水;装置C中过氧化钠吸收一氧化氮反应生成亚硝酸钠,最后通过酸性高锰酸钾溶液除去剩余一氧化氮,防止污染空气,
(1)一氧化氮容易与空气中的氧气反应生成二氧化氮;
(2)A中浓硝酸和碳在加热的条件下发生反应生成二氧化氮、二氧化碳和水,二氧化氮在B中与水反应生成硝酸和一氧化氮,硝酸与铜反应生成硝酸铜和一氧化氮,据此描述反应现象;
(3)A中浓硝酸和碳在加热的条件下发生反应生成二氧化氮、二氧化碳和水;
(4)酸性条件下高锰酸钾氧化一氧化氮为硝酸盐,本身被还原为锰离子,可除去未反应的NO,防止污染空气;
(5)一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,为避免产生这些副产物,应除去二氧化碳和水蒸气;
(6)根据发生的反应①C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O,②3NO2+H2O=2HNO3+NO;③2NO+Na2O2→2NaNO2进行计算。
CO2↑+4NO2↑+2H2O,②3NO2+H2O=2HNO3+NO;③2NO+Na2O2→2NaNO2进行计算。
(1)A中浓硝酸和碳在加热的条件下发生反应生成二氧化氮、二氧化碳和水,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成一氧化氮,一氧化氮易被空气中的氧气氧化,实验开始前通入一段时间气体Ar,可排尽装置内的空气,防止生成的NO被O2氧化;
故答案为:排尽空气,防止生成的NO被O2氧化;
(2)A中浓硝酸和碳在加热的条件下发生反应生成二氧化氮、二氧化碳和水,二氧化氮在B中与水反应生成硝酸和一氧化氮,硝酸与铜反应生成硝酸铜和一氧化氮,所以B中观察到的主要现象是:红棕色气体消失,铜片溶解,溶液变蓝,导管口有无色气泡冒出;
故答案为:红棕色气体消失,铜片溶解,溶液变蓝,导管口有无色气泡冒出;
(3)A中浓硝酸和碳在加热的条件下发生反应生成二氧化氮、二氧化碳和水,化学方程式为:C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
故答案为:C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(4)D装置中高锰酸钾能除去未反应的NO,防止污染空气,高锰酸钾能氧化一氧化氮生成硝酸根,本身被还原为二价锰离子,离子方程式:3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O;
故答案为:3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O;
(5)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,故C产物中除亚硝酸钠外,还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物,应在B、C装置间增加盛有碱石灰的装置E,碱石灰能够吸收二氧化碳和水蒸气;
故答案为:NaOH;碱石灰;
(6)![]() ,根据2NO+Na2O2=2NaNO2知,0.04mol过氧化钠完全反应,需要0.08molNO,设参加反应的碳为x mol,根据C+4HNO3(浓)
,根据2NO+Na2O2=2NaNO2知,0.04mol过氧化钠完全反应,需要0.08molNO,设参加反应的碳为x mol,根据C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;知生成4x molNO2,根据3NO2+H2O=2HNO3+NO可知4x molNO2与水反应生成4xmol×
CO2↑+4NO2↑+2H2O;知生成4x molNO2,根据3NO2+H2O=2HNO3+NO可知4x molNO2与水反应生成4xmol×![]() =
=![]() xnmol硝酸和
xnmol硝酸和![]() xmolNO,再根据3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O可知,硝酸与铜反应生成的NO为
xmolNO,再根据3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O可知,硝酸与铜反应生成的NO为![]() xmol×
xmol×![]() =
=![]() xmol,所以
xmol,所以![]() xmol+
xmol+![]() xmol=2xmol=0.08mol,得x=0.04mol,则C的质量=12g/mol×0.04mol=0.48g,
xmol=2xmol=0.08mol,得x=0.04mol,则C的质量=12g/mol×0.04mol=0.48g,
故答案为:0.48。


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】在25℃时,有pH为a的盐酸和pH为b的NaOH溶液,取VaL该盐酸,同该NaOH溶液中和,需VbLNaOH溶液,填空:
(1)若a+b=14,则Va:Vb=_________(填数字)。
(2)若a+b=13,则Va:Vb=_________(填数字)。
(3)若a+b>14,则Va:Vb=_________(填表达式),且Va__________Vb(填:>、<、=)(题中a≤6、b≥8)。
查看答案和解析>>
科目:高中化学 来源: 题型:
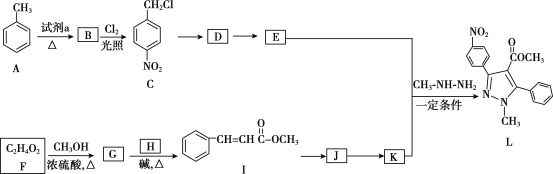
【题目】吡唑类化合物是重要的医用中间体,如图是吡唑类物质L的合成路线。
已知:R1—CHO+R2CH2—COOR3![]()
R1—CHO+R2NH2![]() R1—CH=N—R2
R1—CH=N—R2
(1)试剂a是__。
(2)C生成D的反应类型是__。
(3)D生成E的化学方程式是___。
(4)生成G的化学方程式是__。
(5)H的结构简式是__。
(6)写出符合下列条件的I的同分异构体的结构简式__。
a.是反式结构
b.能发生银镜反应
c.苯环上的一氯代物有2种
d.1mol该有机物能与2mol氢氧化钠反应
(7)K的分子式是C10H8O2,K的结构简式是__。
(8)以2-甲基丙烯和乙酸为原料,选用必要的无机试剂,合成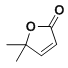 ,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,在“
时,在“![]() ”的水溶液体系中,
”的水溶液体系中,![]() ,
,![]() 和
和![]() 三者中各自所占的物质的量分数
三者中各自所占的物质的量分数![]() 随溶液pH变化的关系如图所示。下列说法正确的是
随溶液pH变化的关系如图所示。下列说法正确的是
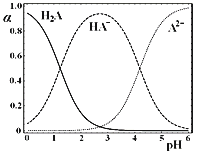
A.在含![]() A、
A、![]() 和
和![]() 的溶液中,加入少量NaOH固体,
的溶液中,加入少量NaOH固体,![]() 一定增大
一定增大
B.将等物质的量的NaHA和![]() 混合物溶于水,所得溶液中
混合物溶于水,所得溶液中![]()
C.NaHA溶液中,![]() 的水解能力大于
的水解能力大于![]() 的电离能力
的电离能力
D.在含![]() A、
A、![]() 和
和![]() 的溶液中,若
的溶液中,若![]() ,则
,则![]() 与
与![]() 不一定相等
不一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫各微粒![]() 、
、![]() 和
和![]() 存在于
存在于![]() 与NaOH溶液反应后的溶液中,它们的物质的量分数
与NaOH溶液反应后的溶液中,它们的物质的量分数![]() 与溶液pH的关系如下图所示.下列说法正确的是
与溶液pH的关系如下图所示.下列说法正确的是
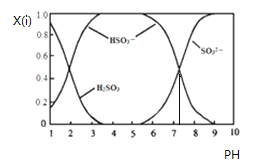
A.![]() 时,溶液中
时,溶液中![]()
B.![]() 时,溶液中
时,溶液中![]()
C.为获得尽可能纯的![]() ,可将溶液的pH控制在
,可将溶液的pH控制在![]() 左右
左右
D.由图中数据可估算出![]() 为
为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a(![]() )、b(
)、b(![]() )、c(
)、c(![]() )的说法正确的是( )
)的说法正确的是( )
A.a、b、c的分子式均为C8H8
B.a、b、c中只有a的所有原子可能处于同一平面
C.a、b、c的一氯代物中,b有1种,a、c均有5种(不考虑立体异构)
D.a、b、c均能与溴水发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg(V/V0)的变化如图所示。
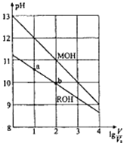
(1)MOH是___(填“强碱”或“弱碱”)。
(2)写出ROH的电离方程式___。
(3)若溶液体积相等,为了使MOH溶液与ROH溶液稀释后pH相等,加入水较多的是___。
(4)常温下,在ROH溶液中加蒸馏水稀释,下列物理量变大的是___。
A.Kw B.![]() C.c(H+) D.c(OH-)
C.c(H+) D.c(OH-)
(5)ROH的电离程度:b点___a点(填“大于”、“小于”或“等于”,下同);若无限稀释MOH、ROH溶液,最终溶液的pH:MOH溶液___ROH溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2—二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用如图所示装置制备1,2—二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,用于制备乙烯,试管d中装有液溴(表面覆盖少量水)。下列有关说法不正确的是( )
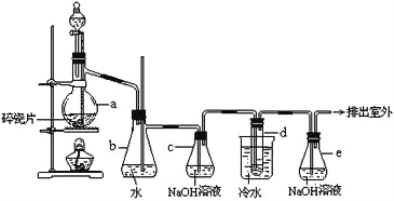
A.实验中为了防止有机物大量挥发,应迅速升高反应温度至170℃
B.装置c和装置e中都盛有NaOH溶液,其吸收的杂质不相同
C.制备乙烯和生成1,2—二溴乙烷的反应类型分别是消去反应和加成反应
D.向d中产物加入饱和Na2CO3溶液震荡静置,可用分液的方法进行分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。
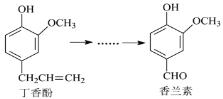
有关上述两种化合物的说法正确的是( )
A.丁香酚不能与FeCl3溶液发生显色反应
B.常温下,1mol丁香酚只能与1molBr2反应
C.香兰素分子中至少有12个原子共平面
D.1mol香兰素最多能与3mol氢气发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com