
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol﹣1,甲醚可作燃料电池的燃料.
(1)写出甲醚燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8kJ·mol﹣1、393.5kJ·mol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热△H= kJ·mol﹣1;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)![]() CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是 (选填编号,注意大小写)。
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将 (填“变大”、“变小”或“不变”,下同)。
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式的其中一个产物是CO32﹣,请写出该反应的负极反应式 ;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL NaCl溶液,装置如图所示,请写出电解过程中Y电极附近观察到的现象是 ;当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液中C(OH-)= mol/L(假设溶液的体积不变,气体全部从溶液中逸出).

【答案】(1)CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=﹣1455kJ/mol;﹣378.8;
(2)①ad;②变小;
(3)CH3OCH3+16OH﹣12e﹣=2CO2﹣3+11H2O;
(4)Y电极附近溶液中有气体产生,上部分呈黄绿色;1
【解析】解:(1)甲醚的燃烧热为1455kJ/mol,则甲醚燃烧的热化学方程式为:
CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=﹣1455kJ/mol;
H2(g)和C(s)的燃烧热分别是285.8kJ·mol﹣1、393.5kJ·mol﹣1;热化学方程式
①H2(g)+![]() O2(g)=H2O(l)△H=﹣285.8KJ/mol;
O2(g)=H2O(l)△H=﹣285.8KJ/mol;
②C(s)+O2(g)=CO2(g)△H=﹣393.5KJ/mol;
CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=﹣1455kJ/mol;
依据盖斯定律计算①×3+②×2﹣③得到反应热化学方程式为:
2C(s)+3H2(g)+![]() O2(g)═CH2OCH3(g):△H=﹣169.4kJ/mol;
O2(g)═CH2OCH3(g):△H=﹣169.4kJ/mol;
4C(s)+6H2(g)+O2(g)═2CH2OCH3(g):△H=﹣338.8kJ/mol;
故答案为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=﹣1455kJ/mol;△H=﹣378.8kJ/mol;
(2)①a、在反应达平衡前,c(H2)与c(H2O)的比值在变小,故当c(H2)与c(H2O)的比值保持不变时,反应达平衡,故A选;
b、单位时间内有2mol H2消耗时一定会有1mol H2O生成,故不能作为平衡的标志,故B不选;
c、本反应的反应物和生成物全是气体,根据质量守恒可知,在反应过程中气体的质量一直不变,而又是恒容的容器,即气体体积不变,故气体密度ρ=![]() 一直不变,故密度不变不能作为平衡的标志,故c不选;
一直不变,故密度不变不能作为平衡的标志,故c不选;
d、此反应是个气体的物质的量有改变的反应,即在平衡之前,容器中气体的物质的量和压强在变化,故当压强不变时,说明反应达平衡,故d选.故选ad;②反应放热,故升高温度,平衡左移,故CH3OCH3的产率将变小,故答案为:变小;
(3)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,电极反应式为:CH3OCH3+16OH﹣﹣12e﹣=2CO32﹣+11H2O,
(4)电解池中Y电极为阳极,溶液中氯离子失电子发生氧化反应生成氯气,现象是冒气泡,上部溶液呈黄绿色;当燃料电池消耗2.8LO2(标准状况下)物质的量=![]() =0.125mol,电极反应为O2+2H2O+4e﹣=4OH﹣,电子转移为0.5mol,阴极电极方程式:2H2O+ 2e﹣= 2 OH﹣+H2所以n(OH﹣)=0.5 mol,c(OH﹣)= 0.5mol/0.5L=1 mol/L
=0.125mol,电极反应为O2+2H2O+4e﹣=4OH﹣,电子转移为0.5mol,阴极电极方程式:2H2O+ 2e﹣= 2 OH﹣+H2所以n(OH﹣)=0.5 mol,c(OH﹣)= 0.5mol/0.5L=1 mol/L


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】某学生设计了一个“黑笔红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是( )
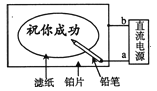
A. 铅笔芯作阳极,发生还原反应
B. 铂片端作阴极,发生氧化反应
C. 铅笔端附近有少量的氯气产生
D. 红字是H+放电,c(OH-)增大造成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)根据下列变化关系:

请填空:
(1)A物质的名称_____ 。B溶液为____________.作用为_________________________
(2)写出④、⑥两步反应的化学方程式,在( )号中标明反应类型。
④ ________________________________________( )
⑥_______________________________________________( )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类组合中正确的是
A | B | C | D | |
强电解质 | Cu(OH)2 | KCl | HCl | CaCO3 |
弱电解质 | NaOH | NH3H2O | BaSO4 | CH3COOH |
非电解质 | SO2 | 金刚石 | NH3 | C2H5OH |
导电物质 | 石墨 | 稀H2SO4 | 熔融KCl | 铜 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g) + CO(g)![]() CH3OH(g)
CH3OH(g)
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
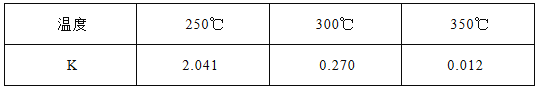
①该反应的熵变△S 0(填:“<,>,=”)。该反应在 (填:高温或低温)条件下能自发进行。
②要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温
b.加入催化剂
c.增加CO的浓度
d.加入H2加压
e.加入惰性气体加压
f.分离出甲醇
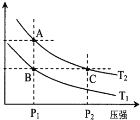
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A__________C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A___________C,由状态B到状态A,可采用___________的方法(填“升温”或“降温”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s) + CO2(g)![]() 2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:
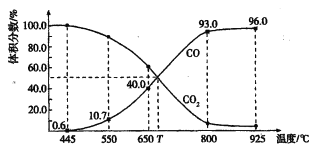
已知:气体分压(P分)=气体总压(p总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,V正、V逆均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为40.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= 23. 04p总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲烷、乙烯是两种常见的有机物气体,为了区别它们,可将它们分别通入__________________。(填“氢氧化钠溶液”、“酸性高锰酸钾溶液”或“稀硫酸");
(2)乙醇和乙酸是生活中两种常见有机物,乙醇的官能团名称是_____________;乙醇和乙酸在浓硫酸作催化剂和加热的条件下发生反应,生成_________(写结构简式)和水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处处留心皆知识.生活中遇到下列问题,不涉及到化学变化的是( )
A.食物腐败变质
B.浓硫酸在空气中体积增大
C.铝表面形成致密的薄膜
D.食醋洗掉水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4![]() 2AsH3↑+6ZnSO4+3H2O。
2AsH3↑+6ZnSO4+3H2O。
(1)请用双线桥法标出电子转移的方向和数目____________________________________。
(2)As2O3在上述反应中显示出来的性质是____________(填序号)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com