
利用下列实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤作用的活性物质。
下列说法错误的是( )
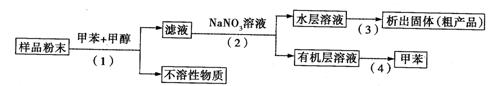
A.步骤(1)需要过滤装置 B.步骤(3)需要用到蒸发皿
C.步骤(4)是利用物质的沸点差异进行分离的
D.活性物质易溶于有机溶剂,难溶于水
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2=6SO2+Fe3O4,氧化产物为 ,若有3mol FeS2参加反应,转移 mol电子。
(2)与明矾相似,硫酸铁也可用作净水剂,其原理为 (用离子方程式表示)。
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为 。
(4)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有无色气体逸出,请写出相应的离子方程式: 。
(5)铁红是一种红色颜料,其成分是Fe2O3将一定量的铁红溶于160mL 5mol•L-1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),往反应后溶液中滴加KSCN溶液,无明显现象,则参加反应的铁粉的质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应2H2S(g)  2H2(g)+S2(g) ΔH >0,其他条件不变,下列说法正确的是
2H2(g)+S2(g) ΔH >0,其他条件不变,下列说法正确的是
A.加入催化剂,反应路径将发生改变,ΔH也将随之改变
B.升高温度,正逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,体系温度降低
D.恒容体系,充入H2重新达到平衡后,H2浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
根据实验目的判断下列实验操作或装置正确的是
| 目的 | A.检验火柴头燃烧 产生的SO2 | B.配制稀硫酸 溶液 | C.分离Cl2与KBr 反应生成的Br2 | D.检查装置 气密性 |
| 装置 或 操作 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

根据题意回答下列问题:
(1)操作Ⅰ的名称是 ,固体X中主要含有 (填写化学式);
(2)用醋酸调节溶液pH=7~8后再进行操作Ⅱ所得固体Y的成分为 (写化学式).
(3)酸化步骤中调节溶液pH<5时发生反应2CrO42-+2H+ 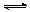 Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为 .
Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为 .
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是
Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是: 。

(5)含铬废渣(废水)的随意排放对人类生存环境有极大的危害。电解法是处理铬污染的一种方法,金属铁作阳极、石墨作阴极电解含Cr2O72-的酸性废水,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。
 ①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3): n (H2)=1:1)
①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3): n (H2)=1:1)
___Fe+___Cr2O72-+___ +___H2O =___Fe(OH)3↓+___Cr(OH)3↓+___H2↑;
②已知常温下Cr(OH)3的Ksp=6.4×10–32mol4/l4,若Ⅰ类生活饮用水水质标准铬含量最高限值是0.052 mg/L,要使溶液中c(Cr3+)降到符合饮用水水质标准,须调节溶液的pH大于______。(已知lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式硫酸铁Fe(OH)SO4对水中的悬浮物、有机物、硫化物、重金属等都能絮凝,工业上常用硫酸亚铁法制备,工艺流程如下图所示:
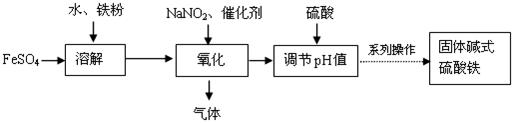
已知: Fe3+沉淀完全时的pH=3.1, Fe2+沉淀完全时的pH=9.7。
(1)请写出溶解过程中加快溶解速率和提高浸出率的两点措施:
_______________________________,______________________________。
(2)加入硫酸的作用是控制体系的pH值,若硫酸加入量过小,反应体系酸度太低,容易生成 沉淀;若硫酸加入量过大,不利于产品形成,试从平衡移动的角度分析原因是 。
(3)氧化过程中生成的气体遇空气变红棕色。写出氧化过程发生的离子方程式:
________________________________________________________________。
(4)流程图中的“系列操作”包括 , ,过滤,洗涤,烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
进行下列实验操作时,一般情况下不应该相互接触的是
A.用移液管移取10 mL NaOH溶液并放于锥形瓶中,移液管的尖嘴和锥形瓶的内壁
B.减压过滤时,布氏漏斗下端管口与吸滤瓶的内壁
C.实验室将HCl气体溶于水时,倒扣的三角漏斗口与烧杯内的水面
D.分液操作分出下层液体时,分液漏斗下端管口和烧杯的内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案中,合理的是
A.可用生石灰除去乙酸中少量水
B.用5 mL苯与1mL浓溴水反应(Fe粉作催化剂)制溴苯
C.向适量浓硝酸、浓硫酸的混合物中逐滴加入苯,在50~60℃的水浴中加热以制取硝
基苯
D.将2.5g苯酚、2.5mL40%的甲醛溶液混合,沸水浴加热制酚醛树脂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断不正确的是( )
A.有时焓变对反应的方向起决定性作用
B.有时熵变对反应的方向起决定性作用
C.焓变和熵变是判断反应方向的两个主要因素
D.任何情况下,温度都不可能对反应的方向起决定性作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com