
【题目】如图是中学化学常见物质的转化关系(某些反应条件及部分产物已略去),A、G为日常生活中的常见金属。B、C、E、I、J为气体,其中C为黄绿色气体,M为红褐色胶体。
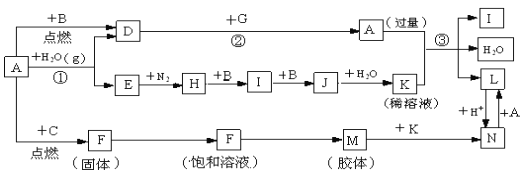
(1)D与G反应的化学方程式________。
(2)L→N的离子方程式_____________。
(3)H→I的化学方程式____________。
(4)现将一试管J气体倒立于水槽中一段时间后,水面上升但不充满;若使水充满整个试管,应向试管中通入一定量_____(填气体的化学式),此时试管中溶液的浓度为____mol/L(气体体积按标准状况计算)(保留两位有效数字)。
【答案】8Al+3Fe3O4 ![]() 4Al2O3+9Fe 3 Fe2++4H++NO3-=3 Fe3++NO↑+2H2O 4NH3+5O2
4Al2O3+9Fe 3 Fe2++4H++NO3-=3 Fe3++NO↑+2H2O 4NH3+5O2 ![]() 4NO+6H2O O2 0.045
4NO+6H2O O2 0.045
【解析】
B、C、E、I、J为气体,其中C为黄绿色气体,则C是Cl2;A、G为日常生活中的常见金属,A能和水蒸气反应,则A是Fe,铁和B反应生成D,B是气体,则D是Fe3O4,B为O2,E是H2;M为红褐色胶体,M为Fe(OH)3;则F是FeCl3,H为NH3,I为NO,J为NO2,K为HNO3;G是生活中常见金属,能发生置换反应,则G是Al;过量铁和稀硝酸反应生成L,L是Fe(NO3)2,硝酸亚铁被氧化生成N,N为Fe(NO3)3,据此分析解答。
(1)D是Fe3O4,G是Al,二者反应的化学方程式为8Al+3Fe3O4 ![]() 4Al2O3+9Fe,故答案为:8Al+3Fe3O4
4Al2O3+9Fe,故答案为:8Al+3Fe3O4 ![]() 4Al2O3+9Fe;
4Al2O3+9Fe;
(2)L→N为硝酸亚铁酸化后被氧化生成铁离子,反应的离子方程式为3 Fe2++4H++NO3-=3 Fe3++NO↑+2H2O,故答案为:3 Fe2++4H++NO3-=3 Fe3++NO↑+2H2O;
(3)H为NH3,I为NO,氨气催化氧化生成NO和水,反应的化学方程式为:4NH3+5O2![]() 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2 ![]() 4NO+6H2O;
4NO+6H2O;
(4)现将一试管气体J(NO2)倒立于水槽中一段时间后,水面上升但不充满;若使水充满整个试管,应向试管中通入一定量氧气,发生反应:4NO2+O2+2H2O=4HNO3;设原试管中二氧化氮气体体积为VL,物质的量为![]() =
=![]() mol,所得溶液中硝酸的物质的量为
mol,所得溶液中硝酸的物质的量为![]() mol,溶液的物质的量浓度为
mol,溶液的物质的量浓度为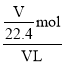 ≈0.045mol/L,故答案为:O2;0.045。
≈0.045mol/L,故答案为:O2;0.045。


科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述中正确的是
A.C5H12有2种同分异构体
B.分子式为C4H10O且与金属钠反应的有机物有4种
C.甲苯的一氯取代物只有3种
D.C8H10中属于芳香烃的同分异构体只有三种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+![]() O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(g) ΔH=242 kJ·mol-1
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2, ②NO2和O2, ③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1.V2、V3 则下列关系正确的是
A. V1>V2>V3 B. V1>V2>V3.
C. V1>V3>V2 D. V3>V1>V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
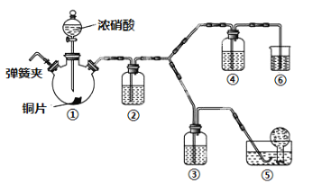
可选药品:浓硝酸、稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。
已知:氢氧化钠溶液不与NO反应,能与NO2反应。2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③④⑥中盛放的药品依次是____、____、_______。
(2)滴加浓硝酸之前的一系列操作依次是检验装置的气密性,加入药品,打开弹簧夹后______。
(3)装置①中发生反应的化学方程式是___________。
(5)该小组得出的结论所依据的实验现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M可广泛用于生物医学、海洋工程、日化用品等领域。其合成路线如图:
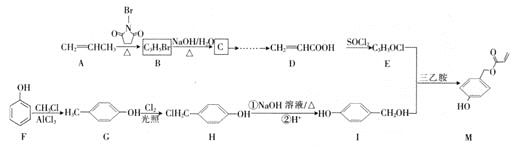
已知:R-COOH![]() R-COCl
R-COCl
回答下列问题:
(1)G的名称为___,D中含氧官能团的名称为___。
(2)M的分子式为___。
(3)F→G的反应类型为___。
(4)E的结构简式为___。
(5)写出B生成C的化学方程式:___。
(6)R为I的同分异构体,R的苯环上含有三个取代基的结构共有___种,写出其中核磁共振氢谱图中峰面积比为3:2:2:1的结构简式:___。
(7)参照本题信息,试写出以1-丁烯为原料制取![]() 的合成路线流程图(无机原料任选)___。合成路线流程图示例如下:
的合成路线流程图(无机原料任选)___。合成路线流程图示例如下:
H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2H2(g)+O2(g)![]() 2H2O(l) ΔH=-571.6 kJ·mol-1
2H2O(l) ΔH=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
③H+(aq)+OH-(aq)![]() H2O(l) ΔH=-57.3 kJ·mol-1
H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A. H2(g)的燃烧热为142.9 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. 1/2H2SO4(aq)+1/2Ba(OH)2(aq)![]() 1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D. 3H2(g)+CO2(g)![]() CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙酸乙酯的主要步骤如下:
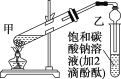
①在甲试管(如图)中加入3mL乙醇、2mL浓硫酸和2mL乙酸的混合溶液。
②按上图连接好装置(装置气密性良好)并加入碎瓷片,用小火均匀地加热3~5min。
③待试管乙中收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯、洗涤、干燥。
(1)配制该混合溶液的主要操作步骤为______;反应中浓硫酸的作用是_____。
(2)写出制取乙酸乙酯的化学方程式:_________。
(3)上述实验中饱和碳酸钠溶液的作用是________(填字母)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(4)欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有________;分离时,乙酸乙酯应该从仪器的________(填“下口放出”或“上口倒出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中![]() 部分短周期元素的原子半径及主要化合价
部分短周期元素的原子半径及主要化合价![]() 信息,判断以下叙述正确的是
信息,判断以下叙述正确的是
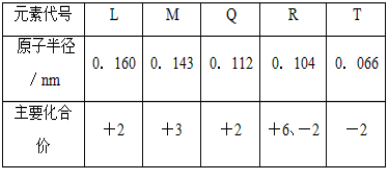
A.氢化物的沸点为![]()
B.L和Q的最高价氧化物对应的水化物的碱性![]()
C.M与T形成的化合物具有两性
D.![]() 与
与![]() 的核外电子数相等
的核外电子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com