
| A. | 甲醛是一种氧化物 | |
| B. | 甲醛中C、H、O的质量比为6:1:8 | |
| C. | 甲醛分子中含有氢分子 | |
| D. | 甲醛是由一个碳原子和一个水分子构成 |
分析 A、氧化物(oxide)是指由两种元素组成且其中一种是氧元素的化合物,如二氧化碳(CO₂)、氧化钙(CaO)等;
B、甲醛中C、H、O的质量比为12:(1×2):16=6:1:8;
C、分子中不可能还含有其他分子,只可能含有原子;
D、甲醛是由一个碳原子和一个水分子构成,说法错误,理由同C.
解答 解:A、甲醛是由三种元素组成的,所以说一它不是氧化物,说法错误;
B、组成甲醛的各元素的质量比为6:1:8,说法正确;
C、每个甲醛分子由一个碳原子、2个氢原子、1个氧原子构成,说法错误;
D、甲醛分子中不可能还有水分子,说法错误.
故选B.
点评 掌握化学式的书写及意义,学会从组成上识别氧化物的方法,并且要掌握关于化学式计算的方法与技巧.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第三周期第ⅡA族 | D. | 第四周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4、C2H4、C3H4 | B. | C2H6、C3H6、C4H6 | C. | CH4、C2H6、C3H8 | D. | C2H4、C2H6、C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2:7 | B. | 5:4 | C. | 1:1 | D. | 7:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:b<c<d | |
| B. | 金属性:d>c | |
| C. | 化合物ae与ce含有的化学键类型相同 | |
| D. | c、d的最高价氧化物对应的水化物之间能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu$→_{△}^{O_{2}}$CuO$\stackrel{H_{2}O}{→}$Cu(OH)2 | |
| B. | Fe2O3$\stackrel{盐酸}{→}$FeCl3溶液$\stackrel{NaOH、过滤、加热}{→}$Fe2O3 | |
| C. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg | |
| D. | Na$→_{△}^{O_{2}}$Na2O$\stackrel{CO_{2}}{→}$Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
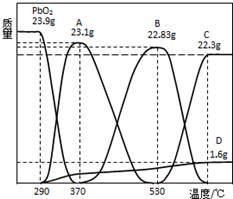 某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l)
某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l)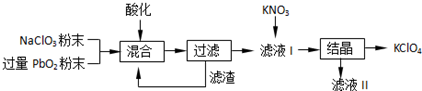
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com