
| 有机物(g) | 氢气(L) |
| 0.575 | 0.14 |
| 1.15 | 0.28 |
| 2.3 | 0.56 |
分析 (1)有机物物质的量为$\frac{0.4869L}{22.4L/mol}$≈0.0217mol,M=$\frac{m}{n}$=$\frac{1g}{0.0217mol}$=46g/mol;
(2)在足量的氧气中充分燃烧,只生成二氧化碳和水蒸汽,说明含有C、H元素,不能确定是否含有O元素;
(3)有机物燃烧产物有二氧化碳和水,将燃烧产物通过足量的石灰水,经过滤可得沉淀10g,10g沉淀应为CaCO3,据此可以计算出二氧化碳的物质的量;再根据水的质量计算出氢原子的物质的量,从而可知该有机物中碳氢个数之比,结合相对分子质量可确定分子式并确定结构简式;
(4)2.3有机物生成0.56L氢气,可确定1mol有机物活泼氢原子数,并确定结构简式;
(5)将一根粗铜丝绕成螺旋状加热,观察到铜丝,迅速伸入盛有该有机物的试管里,反复多次.观察到铜丝,试管中闻到气味,说明有机物被氧化生成醛.
解答 解:(1)有机物物质的量为$\frac{0.4869L}{22.4L/mol}$≈0.0217mol,M=$\frac{m}{n}$=$\frac{1g}{0.0217mol}$=46g/mol,故答案为:46g/mol;
(2)在足量的氧气中充分燃烧,只生成二氧化碳和水蒸汽,说明含有C、H元素,不能确定是否含有O元素,故答案为:C;
(3)有机物燃烧产物有二氧化碳和水,将燃烧产物通过足量的石灰水,经过滤可得沉淀10g,10g沉淀应为CaCO3,有机物的物质的量为$\frac{2.3g}{46g/mol}$=0.05mol,n(C)=n(CaCO3)=$\frac{10g}{100g/mol}$=0.1mol,n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,则有机物含有2个C原子,6个H原子,O原子个数为$\frac{46-24-6}{16}$=1,分子式为C2H6O,可能的结构简式为CH3CH2OH、CH3OCH3,
故答案为:C2H6O;CH3CH2OH;CH3OCH3;
(4)2.3有机物为0.05mol,生成0.56L氢气,即0.025mol氢气,可确定1mol有机物含有1mol活泼氢原子数,则1mol有机物与足量钠完全反应时,生成0.5mol氢气,相当于1mol氢原子;1mol该有机物分子中存在的活泼氢原子为1mol;该有机物的结构简式为CH3CH2OH.
故答案为:0.5;1;1;CH3CH2OH.
点评 本题考查有机物的推断,为高频考点,侧重于学生的分析、计算能力的考查,注意把握有机物分子式的确定,题目难度不大,注意掌握确定有机物分子式常用方法,明确质量守恒在确定有机物分子式的计算中的应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
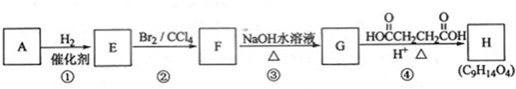
 ;
;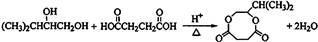 ;
;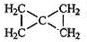 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-COOH | B. | CH2=CH-CH2OH | C. | CH2=CH-CHO | D. | CH2=CH-COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水中,c(H+)•c(OH-)=1×10-14 | |
| B. | 纯水或水溶液中25℃时,c(H+)•c(OH-)=1×10-14 | |
| C. | NaOH溶液在25℃时,c(H+)•c(OH-)>1×10-14 | |
| D. | 溶液浓度改变或酸碱度改变,Kw随之改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3+H2O?NH4++OH- | |
| B. | HCO3-+H2O?H2CO3+OH- | |
| C. | Cu2++2H2O?2Cu(OH)2+2H+ | |
| D. | 2 Fe3++3H2O+3CO32-=2Fe(OH)3↓+3CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
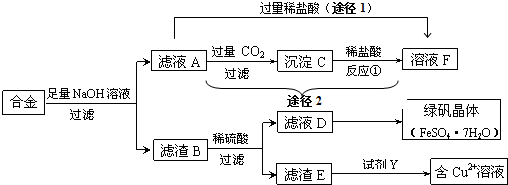
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com