
【题目】某化学学习小组采用下列装置,对浓硝酸与木炭的反应进行探究。
已知:4HNO3![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
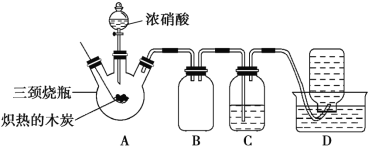
请回答下列问题:
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至红热状态,立即伸入三颈烧瓶中,并塞紧瓶塞,滴加浓硝酸,可观察到三颈烧瓶中气体的颜色为____,产生该气体的主要化学反应方程式是_____。
(2)装置C中盛有足量Ba(OH)2溶液,反应一段时间后可观察到C中出现白色沉淀,该白色沉淀为____(填化学式)。其中的Ba(OH)2溶液___(填“能”或“不能”)用Ca(OH)2溶液代替,理由是_____。
(3)装置B的作用是___。
(4)装置D中收集到了无色气体,部分同学认为是NO,还有部分同学认为是O2。
①下列对该气体的检验方法合适的是__(填序号)。
A.敞口观察集气瓶内气体的颜色变化
B.将润湿的蓝色石蕊试纸伸入集气瓶内,观察试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果集气瓶中收集到的无色气体是氧气,则氧气的来源是____。
【答案】红棕色 C+4HNO3(浓)![]() 4NO2↑+CO2↑+2H2O BaCO3 不能 Ca(OH)2溶液中Ca(OH)2浓度较低,不能形成CaCO3沉淀 防倒吸 AC 浓硝酸的分解
4NO2↑+CO2↑+2H2O BaCO3 不能 Ca(OH)2溶液中Ca(OH)2浓度较低,不能形成CaCO3沉淀 防倒吸 AC 浓硝酸的分解
【解析】
(1)红热的木炭会跟浓硝酸反应生成二氧化氮,因此可观察到三颈烧瓶中气体的颜色为红棕色,反应的化学方程式为C+4HNO3(浓)![]() 4NO2↑+CO2↑+2H2O;
4NO2↑+CO2↑+2H2O;
(2)装置C中的白色沉淀为木炭被氧化产生的二氧化碳气体与氢氧化钡反应生成的碳酸钡,氢氧化钡溶液不能用氢氧化钙代替,因为氢氧化钙溶解度太低,反应现象不明显;
(3)装置B的作用是防倒吸;
(4)①A.敞口观察集气瓶内气体的颜色变化,若变为红色,则气体为一氧化氮,若不变色,则气体为氧气;
B. 将润湿的蓝色石蕊试纸伸入集气瓶内,观察试纸是否变红无法检验该气体,因为一氧化氮和氧气均不会使湿润的蓝色石蕊试纸变色;
C. 将带火星的木条伸入集气瓶中,观察木条是否复燃,若木条复燃,则为氧气,反之则为一氧化氮;
因此答案选AC;
②如果集气瓶中收集到的无色气体是氧气,则氧气的来源是浓硝酸的分解;


科目:高中化学 来源: 题型:
【题目】NaClO2是一中重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图所示。请回答下列问题:
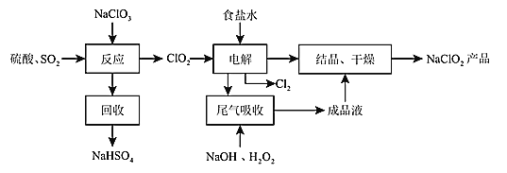
(1)NaClO2中Cl元素的化合价为_____________;
(2)写出“反应”步骤中生成ClO2的化学方程式________________________。
(3)“尾气吸收”步骤中发生的反应为2NaOH + H2O2 + 2ClO2 = 2NaClO2 + O2↑ + 2H2O ,其中氧化剂与还原剂的物质的量之比为_________;若有3 mol 电子发生转移,则有__________L(标准状况下)O2生成。
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,是指每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。则NaClO2的有效氯含量为_____(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酯的合成路线如下图所示

(1)反应Ⅰ反应类型为___________________; D中含氧官能团为_____________写名称)。
(2)反应Ⅱ的反应条件为:_________________。
(3)C→D的化学反应方程式为________________________________________。
(4)写出一种满足下列条件的E的同分异构体的结构简式为__________________________。
①能发生银镜反应 ②含苯环且苯环上一溴代物两种 ③不能与钠反应
(5)写出B合成![]() 的合成路线。合成路线常用的表示方式为:_______________
的合成路线。合成路线常用的表示方式为:_______________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水系钠离子电池安全性能好、价格低廉、对环境友好,有着巨大的市场前景。某钠离子电池工作原理如图,电池总反应为:2NaFePO4F + Na3Ti2(PO4)3![]() 2Na2FePO4F+ NaTi2(PO4)3
2Na2FePO4F+ NaTi2(PO4)3

下列说法错误的是
A.充电时,a接电源正极
B.放电时,溶液中的Na+在NaFePO4F电极上得电子被还原
C.充电时,阴极上的电极反应为NaTi2(PO4)3+2Na++2e﹣=Na3Ti2(PO4)3
D.理论上,该电池在充电或放电过程中溶液中的c(Na+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3
回答下列问题:已知反应①中的相关的化学键键能数据如表:
化学键 | H—H | C—O |
| H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(1)由此计算ΔH1=__kJ·mol-1,已知ΔH2=-58kJ·mol-1,则ΔH3=__kJ·mol-1。
(2)在一定条件下,向2L恒容密闭容器中冲入1molCO2和3molH2发生反应②,5min时测得生成了0.4molH2O,求5min的反应速率v(H2)=__,写出一种能加快反应速率的措施___
(3)甲醇是电动汽车的理想燃料,工作原理如图所示:
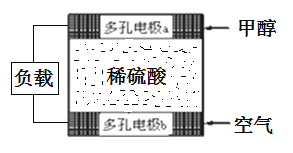
多孔电极b为燃料电池的__极(填“正”或“负”),多孔电极a发生的电极反应式为:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种白色固体,微溶于冷水,不溶于乙醇,化学性质与过氧化钠类似。某学习小组设计在碱性环境中利用CaCl2与H2O2反应制取CaO2·8H2O,装置如图所示:

回答下列问题:
(1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有___。
(2)仪器X的主要作用除导气外,还具有的作用是___。
(3)在冰水浴中进行的原因是___。
(4)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为___。
(5)反应结束后,经过滤、洗涤、低温烘干获得CaO2·8H2O。下列试剂中,洗涤CaO2·8H2O的最佳选择是____。
A.无水乙醇 B.浓盐酸 C.Na2SO3溶液 D.CaCl2溶液
(6)若CaCl2原料中含有Fe3+杂质,Fe3+催化分解H2O2,会使H2O2的利用率明显降低。反应的机理为:
①Fe3+ +H2O2=Fe2++H++HOO·
②H2O2+X=Y +Z+W(已配平)
③Fe2++·OH=Fe3++OH-
④H+ +OH-=H2O
根据上述机理推导步骤②中的化学方程式为___。
(7)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙具有____的性质。
A.与水缓慢反应供氧 B.能吸收鱼苗呼出的CO2气体
C.能是水体酸性增强 D.具有强氧化性,可杀菌灭藻
(8)将所得CaO2·8H2O晶体加热到150~160℃,完全脱水后得到过氧化钙样品。
该小组测定过氧化钙样品中CaO2的纯度的方法是:准确称取0.4000g过氧化钙样品,400℃以上加热至完全分解成CaO和O2(设杂质不产生气体),得到33.60mL(已换算为标准状况)气体。
则:所得过氧化钙样品中CaO2的纯度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH=-99kJ·mol-1。请回答下列问题:
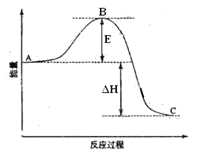
(1)图中A、C分别表示__________、______________,E的大小对该反应的反应热__________(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点______(填“升高”或“降低”),△H_____(填“变大”、“变小”或“不变”)理由是________________;
(2)图中△H =_______kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5。写出该催化循环机理的化学方程式_______________________________。
(4)已知单质硫的燃烧热为296KJ·mol-1,计算由S(s)生成3molSO3(g)的△H(写出计算过程):________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)Fe2(SO4)3(写出电离方程式)_____
(2)铝和氢氧化钠溶液混合(写出反应的离子方程式)_____
(3)2H++CO32﹣═H2O+CO2↑(改写成化学方程式)________
(4)除去NaHCO3溶液中混有少量 Na2CO3溶液的离子反应方程式_____.
Ⅱ.有一瓶溶液只含Cl﹣、CO32﹣、SO42﹣、Na+、Mg2+、Cu2+六种离子中的某几种通过实验:
①原溶液![]() 白色沉淀;
白色沉淀;
②原溶液中加BaCl2溶液不产生沉淀;
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解.
(1)试分析原溶液中一定含有的离子是_____,一定不含有的离子是_____,
(2)有的同学认为实验③可以省略,你认为是否正确_____(填是或否),理由是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,把2. 0体积的N2和6. 0体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H2![]() 2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是( )
2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是( )
A. 1.0体积的N2和3.0体积的H2
B. 2.0体积的N2和6.0体积的H2和4.0体积的NH3
C. 4.0体积的NH3和1.0体积的H2
D. 2.0体积的NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com