
| A. | 两次平衡时,C(g)的浓度相等 | |
| B. | 平衡时,单位时间内n(B)生成:n(C)消耗=1:1 | |
| C. | 若再向平衡体系中加入少量A,平衡不移动 | |
| D. | 若开始时向容器中加入1 mol B和1 mol C,则达到平衡时吸收QkJ热量 |
分析 A.缩小容器体积,压强增大,平衡逆向移动,但A为固体,B、C的物质的量始终为1:1;
B.不同物质的正逆反应速率之比等于化学计量数之比,为平衡状态;
C.A为固体,加入少量A,对平衡移动无影响;
D.为可逆反应,加入1 mol B和1 mol C,不能完全转化为A.
解答 解:A.缩小容器体积,压强增大,平衡逆向移动,但A为固体,B、C的物质的量始终为1:1,体积、物质的量均减小,则两次平衡时,C(g)的浓度相等,故A正确;
B.不同物质的正逆反应速率之比等于化学计量数之比,为平衡状态,则平衡时,单位时间内n(B)生成:n(C)消耗=1:1,故B正确;
C.A为固体,加入少量A,对平衡移动无影响,可知平衡不移动,故C正确;
D.为可逆反应,加入1 mol B和1 mol C,不能完全转化为A,达到平衡时吸收热量小于QkJ,故D错误;
故选D.
点评 本题考查化学平衡的移动,为高频考点,把握压强对平衡移动的影响、平衡判定为解答的关键,侧重分析与应用能力的考查,注意选项A为解答的难点,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | .原子半径X>Y>Z | |
| B. | .非金属性 X>Y>Z | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | .阴离子的还原性按X、Y、Z顺序由强到弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和石油的分馏都属于化学变化 | |
| B. | 石油裂化获得的产品是混合物 | |
| C. | 石油主要含C、H、O三种元素 | |
| D. | 煤焦油经过分馏可得到苯、甲苯等,说明煤中含有苯和甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁比软铁芯(几乎是纯铁)容易生锈 | |
| B. | 银质奖牌久置后表面变暗 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
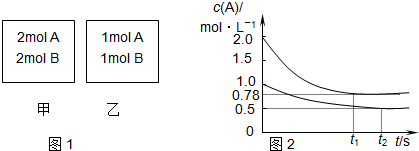
| A. | x=1 | |
| B. | 将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同 | |
| C. | 若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中:0.78 mol•L-1<c(A)<1.56 mol•L-1 | |
| D. | 若甲容器为等压可变容器,向甲中充入惰性气体,则c(A)减小,平衡正向移动,v(正)、v(逆)减 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用AgNO3溶液可以鉴别KCl和KI | |
| B. | 制备乙酸乙酯时可用饱和Na2CO3溶液收集产物以除去其中的乙酸 | |
| C. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 | |
| D. | SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com