
| A. | 增大压强,平衡向右移动 | B. | 加入催化剂,Z的产率增大 | ||
| C. | 增大c(X),X的转化率增大 | D. | 降低温度,Y的转化率增大 |
科目:高中化学 来源: 题型:选择题
| A. | 碳酸的电离:H2CO3═2H++HCO3- | |
| B. | 将金属钠加入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 硫化钠水解:S2-+2H2O?H2S↑+2OH- | |
| D. | 向氯化铝溶液中加入过量的烧碱溶液:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
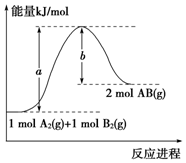
| A. | 每生成2分子AB吸收b kJ热量 | |
| B. | 该反应过程的活化能为b kJ•mol-1 | |
| C. | 断裂1 mol A-A和1 mol B-B键,放出a kJ能量 | |
| D. | 该反应的反应热△H=+(a-b) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、K+、NO3-、Cl- | B. | Mg2+、Na+、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、OH-、Cl- | D. | H+、Na+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
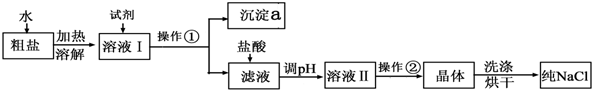

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| CO | Cl2 | COCl2 | COCl2 | ||
| Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
| Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
| Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
| A. | 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol•L-1•min-1 | |
| B. | 该反应正反应为吸热反应 | |
| C. | 容器Ⅱ中起始时Cl2的物质的量为0.55 mol | |
| D. | 若起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A. | 0~20 s内,v(NO2)=0.005 mol•L-1•s-1 | |
| B. | 59 s时,c(NO2)一定大于0.12 mol•L-1 | |
| C. | 若仅将起始时充入NO2的量增至0.80 mol,则该反应的平衡常数K>$\frac{25}{9}$ | |
| D. | 若上述反应在120℃时进行,则反应至80 s时,n(N2O4)<0.08 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com