
【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第4周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
元素 | 相关信息 |
A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B | 元素原子的核外p电子数比s电子数少1 |
C | 原子的第一至第四电离能分别是I1=738 kJ·mol-1; I2=1 451 kJ·mol-1;I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1 |
D | 原子核外所有p轨道全满或半满 |
E | 元素的主族序数与周期数的差为4 |
F | 是前四周期中电负性最小的元素 |
G | 在周期表的第七列 |
(1)B基态原子中能量最高的电子,其电子云在空间有______个伸展方向,原子轨道呈________形。
(2)某同学根据上述信息,推断C基态原子的轨道表示式为![]() 该同学所画的轨道表示式违背了________________。
该同学所画的轨道表示式违背了________________。
(3)G位于______族__________区,价电子排布式为________________。
(4)检验F元素的方法是________,请用原子结构的知识解释产生此现象的原因:_____________。
(5)写出E的单质与水反应的离子方程式:_____________________________________
(6)写出DA3的电子式_______________________(用元素符号)
【答案】3 哑铃 泡利原理 ⅦB d 3d54s2 焰色反应 基态原子的电子吸收能量后,电子会跃迁到较高的能级,变成激发态电子,电子从能量较高的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量 Cl2+H20==H++Cl-+HClO ![]()
【解析】
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,A为H元素;
B元素原子的核外p电子数比s电子数少1,B有2个电子层,为1s22s22p3,故B为N元素;
由C原子的第一至第四电离能数据可知,第三电离能突然增大,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;
D处于第三周期,D原子核外所有p轨道全满或半满,最外层排布为3s23p3,故D为P元素;
E处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素;
F是前四周期中电负性最小的元素,F为第四周期元素,故F为K元素,
G在第四周期周期表的第7列,G为Mn元素。
(1)(1)B是N原子,基态原子中能量最高的电子排布在2p能级上,其电子云在空间有px、py、pz 3个伸展方向,原子轨道呈哑铃形。
(2) 根据泡利不相容原理,1个原子轨道只能容纳2个自旋方向相反的电子,该同学所画的电子排布图中3s能级,2个电子自旋方向相同,违背了泡利原理;
(3)G为Mn元素,是25号元素,位于第四周期第ⅦB族,最后填充的为d电子,为d区元素,价电子排布式为3d54s2;
(4) 当基态原子的电子吸收能量后,电子会跃迁到较高的能级,变成激发态电子,电子从能量较高的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量;含有K元素的溶液在酒精灯火焰上灼烧时,透过蓝色钴玻璃能观察到紫色火焰,检验K元素的方法是焰色反应。
(5)E是Cl元素,氯气与水反应生成盐酸和次氯酸,反应的离子方程式是Cl2+H2O==H++Cl-+HClO;
(6)PH3中心原子P原子满足8电子稳定结构,电子式为![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】鸡没有汗腺,只能依赖“喘息”调节体温。鸡过度地呼出CO2,使下列平衡向左移动,导致蛋壳变薄,使农场主和超市经营者蒙受经济损失。CO2(g)![]() CO2(aq),CO2(aq) + H2O
CO2(aq),CO2(aq) + H2O![]() H2CO3(aq);H2CO3(aq)
H2CO3(aq);H2CO3(aq)![]() H+(aq) + HCO3-(aq);HCO3-(aq)
H+(aq) + HCO3-(aq);HCO3-(aq) ![]() H+(aq) + CO32-(aq);Ca2+(aq) + CO32-(aq)
H+(aq) + CO32-(aq);Ca2+(aq) + CO32-(aq) ![]() CaCO3(s)(蛋壳)。澳大利亚学者研究发现,夏季给鸡喂食下列某种饮料会使蛋壳变厚,这种饮料可能是( )
CaCO3(s)(蛋壳)。澳大利亚学者研究发现,夏季给鸡喂食下列某种饮料会使蛋壳变厚,这种饮料可能是( )
A.淡盐水B.碳酸水
C.蔗糖D.澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的结构决定性质。回答下列有关问题:
(1)BF3的空间构型为______。SO32-中心原子的杂化类型是______。
(2)H2S的沸点比H2O2的沸点______![]() 选填“高”或“低”
选填“高”或“低”![]() ;氮化铝、氮化硼、氮化镓三种晶体的结构与金刚石类似,其中熔点最高的是______。
;氮化铝、氮化硼、氮化镓三种晶体的结构与金刚石类似,其中熔点最高的是______。
(3)从分子结构的角度分析“白磷不溶于水,易溶于CS2”的原因______。
(4)CuCl难溶于水但易溶于氨水,其原因是______;此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为______。
(5)已知CaF2晶胞结构如图所示,晶体密度为![]() g/cm3,则晶胞的边长是______cm。(NA表示阿伏加德罗常数,用含
g/cm3,则晶胞的边长是______cm。(NA表示阿伏加德罗常数,用含![]() 、NA的代数式表达)
、NA的代数式表达)

(6)一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶点位置,该晶体中原子之间的作用力是______;该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述正确的是
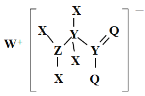
A.Z的最高价氧化物对应的水化物是一元强酸
B.WX的水溶液呈中性
C.元素非金属性的顺序为Y>Z>Q
D.该化合物中与Y单键相连的Q不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)1 mol CO2中含有的σ键数目为________,π键数目为________。
(2)已知CO和CN-与N2结构相似,CO分子内σ键与π键个数之比为________。CH2=CHCN分子中σ键与π键数目之比为________。
(3)肼(N2H4)分子可视为NH3分子中的—个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) ΔH=-1 038.7 kJ·mol-1若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
(4)Co 基态原子核外电子排布式为____________;
基态Ge原子的核外电子排布式为____________;
Zn2+的价电子轨道表示式为_______________;
Co3+核外电子未成对电子数为__________________。
(5)CH4、NH3、H2O、HF分子中共价键的极性由强到弱的顺序是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蓓萨罗丁是一种治疗顽固性皮肤T细胞淋巴瘤的药物,其结构如图所示。下列有关说法正确的是

A. 分子中所有碳原子在同一平面内
B. 既能发生加成反应,又能发生消去反应
C. 能使溴水、酸性高锰酸钾溶液褪色,且原理相同
D. 1mol蓓萨罗丁分别与足量的Na、 NaHCO3反应,产生气体的物质的量之比为l︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③
则反应①自发进行的条件是______________,ΔH3=______________kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g) ![]() 2NH3(g)。
2NH3(g)。
(2)在不同温度、压强和相同催化剂条件下,初始N2、H2 分别为0.1 mol、0.3 mol时,平衡后混合物中氨的体积分数(φ)如下图所示。

①其中,p1、p2 和p3 由大到小的顺序是______________________________,其原因是__________________________________________________________________。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)________vB(N2)(填“>”“<”或“=”)。
③若在250 ℃、p1 为105 Pa条件下,反应达到平衡时容器的体积为1 L,则该条件下B点N2 的分压p(N2)为_____________________Pa (分压=总压×物质的量分数,保留一位小数)。
Ⅲ.以连二硫酸根(S2O![]() )为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

(3)①阴极区的电极反应式为_________________________________。
②NO吸收转化后的主要产物为NH![]() ,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为________mL。
,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为________mL。
Ⅳ、常温下,将a mol·L-1的醋酸与b mol·L-1Ba(OH)2 溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=___________(用含a和b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图),下列说法错误的是( )

A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用做净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行,该反应的离子方程式为:Fe2++2HCO3-= FeCO3+ CO2↑+H2O
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 该温度下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3、KAl(SO4)2·12H2O等可作净水剂,原因是_____________、__________________(离子方程式和文字说明)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com