
【题目】现有NaHCO3和Na2CO3·xH2O的混合物7.4g, 加热到反应完全,并让产生的气体依次被无水氯化钙B和碱石灰C完全吸收,冷却至室温时,测得B管增重3.78g,C管增重044g,请计算下来问题:
(1)残留固体的成分是_______,质量是________。
(2)原混合物中NaHCO3的质量是_________。
(3)求出x的值(要求有计算过程)。
【答案】
(1)Na2CO3;3.18g;
(2)1.68g;(3)10
【解析】
试题分析:(1)加热发生反应:2NaHCO3 ![]() Na2CO3 +CO2↑+H2O、Na2CO3xH2O
Na2CO3 +CO2↑+H2O、Na2CO3xH2O![]() Na2CO3 +xH2O,测得B管增重3.78克为生成的水的质量,C管增重0.44克为生成的CO2的质量,残留固体为碳酸钠,根据质量守恒,残留固体质量=7.4g-3.78g-0.44g=3.18g,故答案为:Na2CO3;3.18;
Na2CO3 +xH2O,测得B管增重3.78克为生成的水的质量,C管增重0.44克为生成的CO2的质量,残留固体为碳酸钠,根据质量守恒,残留固体质量=7.4g-3.78g-0.44g=3.18g,故答案为:Na2CO3;3.18;
(2)碳酸氢钠加热分解生成二氧化碳为0.44g,则:
2NaHCO3 ![]() Na2CO3 +CO2↑+H2O
Na2CO3 +CO2↑+H2O
168 44
m(NaHCO3) 0.44g
所以m(NaHCO3)=![]() =1.68g,故答案为:1.68g;
=1.68g,故答案为:1.68g;
(3)2NaHCO3 ![]() Na2CO3 +CO2↑+H2O
Na2CO3 +CO2↑+H2O
44 18
0.44g 0.18g
故碳酸钠晶体加热分解生成水的质量=3.78g-0.18g=3.6g,碳酸钠晶体的质量=7.4g-1.68g=5.72g,
Na2CO3xH2O![]() Na2CO3 +xH2O
Na2CO3 +xH2O
(106+18x) 18x
5.72g 3.6g
所以(106+18x):18x=5.72g:3.6g,解得x=10,答:x的值是10。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】DME(二甲醚、CH3OCH3)是一种重要的清洁能源,可作为柴油的理想替代燃料和民用燃料,被誉为“二十一世纪的新能源”。另外,二甲醚还被广泛用作致冷剂、气雾剂以及有机化工中间体。
(1)工业上一步法制二甲醚的生产流程如下:
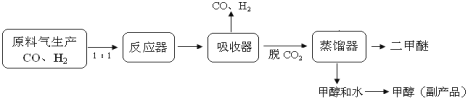
在一定的温度(230-2800C)、压强(2-10MPa)和催化剂作用下,反应器中进行下列一些反应:
CO(g)+2H2(g)![]() CH3OH(g)△H=—90.7kJ·mol—1
CH3OH(g)△H=—90.7kJ·mol—1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H=—23.5kJ·mol—1
CH3OCH3(g)+H2O(g)△H=—23.5kJ·mol—1
CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=—41.2kJ·mol—1
CO2(g)+H2(g)△H=—41.2kJ·mol—1
反应器中总反应式可表示为:3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g),则该反应的△H = 。
CH3OCH3(g)+CO2(g),则该反应的△H = 。
(2)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。
CH3OCH3(g)+3H2O(g) △H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。
A.容器中密度不变 B.容器内压强保持不变
C.v(CO2)︰v(H2)=1︰3 D.单位时间内消耗2molCO2,同时消耗1mol二甲醚
(3)二甲醚也可以通过CH3OH分子间脱水制得2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H = —23.5kJ·mol—1 ,在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
CH3OCH3(g)+H2O(g) △H = —23.5kJ·mol—1 ,在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。

T1℃时,若改变起始浓度,某时刻各组分浓度依次为:C(CH3OH)=0.4mol/L 、C(H2O)=0.6 mol/L、C(CH3OCH3)=
1.2 mol/L,此时正、逆反应速率的大小:V正_______V逆(填“>”、“<”、或“=”)。
(4)如图为二甲醚燃料电池的工作原理示意图。请回答下列问题:
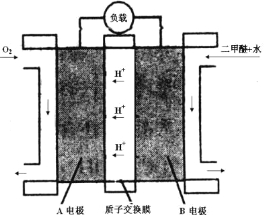
①A电极是 极。
②B电极上发生的电极反应式是 。
③若燃料电池中通入二甲醚(沸点为-24.9 ℃)的速率为1.12L/min(标准状况),以该燃料电池作为电源电解2 mol·L—1CuSO4溶液500mL,则通电30秒钟后理论上在阴极可析出金属铜 g(假设整个过程中,能量利用率为75%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.1mol任何物质都含有6.02×1023个原子
B.0.012kg12C 含有阿伏加德罗常数个碳原子
C.在使用摩尔表示物质的量的单位时,应指明粒子的种类
D.物质的量是国际单位制中七个基本物理量之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两种烃,它们含碳质量分数相同,下列关于A和 B的叙述正确的是
A.A和 B一定是同分异构体 B.A和 B不可能是同系物
C.A和 B最简式一定相同 D.A和 B的化学性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙烯的说法中错误的是
A.乙烯可以催熟植物的果实
B.乙烯生成聚乙烯的反应是乙烯分子互相加成反应
C.聚乙烯由乙烯聚合而成,故分子中含有很多碳碳双键
D.聚乙烯的单体是乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,向Cu(IO3)2饱和溶液中加入足量的经稀硫酸酸化的KI溶液,产生碘化亚铜(CuI)沉淀,溶液由蓝色变为棕黄色,反应前加入淀粉溶液不变蓝,反应后加入淀粉溶液变为蓝色。
(1)该反应中氧化剂是__________;
(2)该反应的氧化产物是__________;
(3)1mol氧化剂在反应中得到电子的物质的量为__________;
(4)某反应体系中有物质:Bi2(SO4)3、NaMnO4、H2O、MnSO4、NaBiO3、Na2SO4、H2SO4 。请将NaBiO3之外的反应物与生成物分别填入以下空格内,配平化学计量数,并用单线桥表示电子转移的方向和数目。
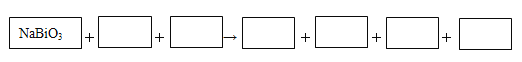
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“神舟七号”的燃料是氢化锂三兄弟——LiH、LiD、LiT。其中Li的质量数为7,对这三种物质的下列说法正确的是
A. 质子数之比为1:2:3 B. 中子数之比为1:1:1
C. 摩尔质量之比为8:9:10 D. 化学性质不相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com