
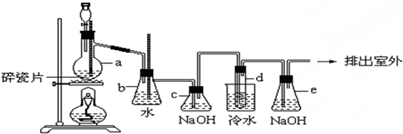
分析 实验原理:乙醇和浓硫酸反应主要生成乙烯气体,还可能混有碳和浓硫酸反应生成的CO2和SO2气体,b为安全瓶,c为净化除杂装置,d为乙烯和溴的反应装置,e为尾气吸收装置;
(1)实验室中用乙醇和浓硫酸加热来制取乙烯,然后用乙烯和溴单质的加成反应来制得1,2-二溴乙烷;
(2)依据当d堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管;
(3)浓硫酸有脱水性,使乙醇脱水,生成碳,呈黑色;
(4)C为净化装置,e为尾气吸收装置;
(5)乙醇和浓硫酸混合液没有完全反应生成乙烯.
解答 解:(1)实验室中用乙醇和浓硫酸加热来制取乙烯,然后用乙烯和溴单质的加成反应来制得1,2-二溴乙烷,发生反应的化学方程式为:CH3CH2OH$→_{浓硫酸}^{170℃}$CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br;
故答案为:CH3CH2OH$→_{浓硫酸}^{170℃}$CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br;
(2)试管d发生堵塞时,b中压强不断增大,会导致b中水面下降,玻璃管中的水柱上升,甚至溢出,
故答案为:b中水面会下降,玻璃管中的水面会上升,甚至溢出;
(3)a中反应物为乙醇和浓硫酸的混合液,浓硫酸有脱水性,乙醇是由C、H、O三种元素组成的有机物,浓硫酸可以使乙醇脱水,生成碳,呈黑色;
故答案为:浓硫酸有脱水性,能使乙醇脱水生成碳,呈黑色;
(4)a中浓硫酸可以使部分乙醇脱水,生成碳,碳和浓硫酸反应生成H2O、CO2和SO2气体,混合气体通过c瓶,CO2和SO2气体被氢氧化钠吸收,d中乙烯和溴反应后,没有反应完的溴被e瓶的氢氧化钠吸收,防止污染空气;
故答案为:除去乙烯中混有的CO2和SO2气体;吸收没有反应的溴,防止污染空气;
(5)当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多的原因可能是乙烯发生(或通过液溴)速度过快,导致大部分乙烯没有和溴发生反应;此外,也可能是实验过程中,乙醇和浓硫酸混合液没有完全反应生成乙烯,主要原因有:①随反应进行浓硫酸变稀,不再和乙醇发生反应,②乙醇和浓硫酸的混合液没有迅速达到170℃(答“控温不当“亦可),会导致副反应的发生和副产物的生成,③浓硫酸可以使部分乙醇脱水,生成碳,碳和浓硫酸反应生成H2O、CO2和SO2气体;
故答案为:乙醇和浓硫酸混合液没有完全反应生成乙烯,或乙烯发生(或通过液溴)速度过快.
点评 本题考查了制备实验方案的设计、溴乙烷的制取方法,题目难度不大,注意掌握溴乙烷的制取原理、反应装置选择及除杂、提纯方法是解题的关键,注重培养学生分析问题、解决问题的能力.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:解答题
| 温度(℃) | 10 | 40 | 75 |
| 剩余固体质量(g) | 201 | 132 | 72 |
| 温度(℃) | 10 | 40 | 75 |
| 溶解度 | 81 | 104 | 150 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N层比M层少8个电子的元素 | B. | L层比M层多一个电子的元素 | ||
| C. | 最高价为+6价的元素 | D. | 无负化合价的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢化物 | A | B | C | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | -33 | -162 |

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现 | |
| B. | 元素的性质随着原子序数的增加而呈周期性变化 | |
| C. | 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 | |
| D. | 可以利用元素周期律预测新元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用福尔马林对种子消毒不属于蛋白质变性 | |
| B. | 能用新制的氢氧化铜鉴别果糖与葡萄糖溶液 | |
| C. | 实验证实化合物 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 | |
| D. | 化合物的 分子式为C13H8O4N2 分子式为C13H8O4N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  浴擦肥皂时,暂时关上喷头 | B. |  洗衣后的水用来拖地 | ||
| C. |  水龙头坏了,立即进行修理 | D. |  用水管不间断地冲洗汽车 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com