
����Ŀ��ijͬѧ������װ�ü���Cl2�����ʡ�
|
|
|
�� |
| �� |
��1��Iͼ����ɫ����______���a����b������Iͼ�ձ��з�����Ӧ�����ӷ���ʽ��______��
��2����ͼ�е�������_________��
��3����ͭ˿������˿������ʵ�飬���Ҳ�ܵ�ȼ������Ϊ��˿Ҳ�ܵ�ȼ��������_______����ѡ����ĸ����
A Fe��Cu���ǽ���Ԫ�� B Fe���۵��Cu��
C Fe���ܶȱ�CuС D Fe�����ʱ�Cu����
��4������װ�÷����ڹ����ĵط����չ�û��ֱ����������һ�������Ͳ�ڻ���ɫ������ɫ��dz����Ͳ��Һ�������ȡ������������������Ϊ60%������֪��������������52.8%�����ղ��ᷢ����ը��
����Ͳ��Һ��������ԭ����_________��
��ˮ���ñ���ʳ��ˮ������ˮ��ԭ����_________��
���𰸡�b Cl2+2OH-=Cl-+ClO-+H2O ����ȼ�գ������ػ�ɫ�� D ���ɵ��Ȼ�������ˮ ������ʳ��ˮ�е��ܽ��С
��������
����ͨ��ʵ�鿼�����������ʣ�����������Ư���ԡ������ԡ�����鷴Ӧ��ʵ�飬���ܸ���ʵ���������������Ľ��͡�
��1���������������ʹ�������ɫ������ɫ������������ʪ�����ɫ����ʱ��������ˮ��Ӧ���ɴ����ᣬ���������Ư���ԣ�ʹ��ɫ������ɫ��Iͼ����ɫ����b��Iͼ�ձ���NaOH��Cl2������Ӧ�����ӷ���ʽ��Cl2+2OH-=Cl-+ClO-+H2O��
��2��ͭ˿�������о���ȼ�գ������ػ�ɫ�̣�
��3����ΪFe�����ʱ�Cu���ã�����FeҲ����������ȼ�գ�D��ȷ��
��4����CH4+Cl2![]() CH3Cl+HCl��CH3Cl+ Cl2
CH3Cl+HCl��CH3Cl+ Cl2![]() CH2Cl2+HCl��CH2Cl2+ Cl2
CH2Cl2+HCl��CH2Cl2+ Cl2![]() CHCl3+HCl��CHCl3+ Cl2
CHCl3+HCl��CHCl3+ Cl2![]() CCl4+HCl���������ɵ��л�����ֻ��CH3Cl�����壬CH2Cl2��CHCl3��CCl4��Һ�壬�������ɵ�HCl������ˮ������Ͳ�е�Һ��������
CCl4+HCl���������ɵ��л�����ֻ��CH3Cl�����壬CH2Cl2��CHCl3��CCl4��Һ�壬�������ɵ�HCl������ˮ������Ͳ�е�Һ��������
�����͵�ʳ��ˮ��Cl-��Ũ�ȱȽϴ���������ˮ�е��ܽ�ȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��0.2molij��A����������ȫȼ�պ�����CO2��H2O��1.2mol���Իش�
������A����ʹ��ˮ��ɫ������һ��������������������ȡ����Ӧ����һ��ȡ����ֻ��һ�֣�����A�Ľṹ��ʽΪ________��
�� ����A��ʹ��ˮ��ɫ���ڴ��������£���H2�ӳɷ�Ӧ������2��2���������飬����A��������_______���ṹ��ʽ��______��
�۱���A������̼ԭ������ʹ��ˮ��ɫ��A��ͬϵ����__��ͬ���칹��
��2�����з����У���˴Ź���������ֻ��һ�ַ壨�źţ���������_____��
A. CH3��CH3 B. CH3COOH C. CH3COOCH3 D. CH3COCH3
��3��������A��B�ķ���ʽ����C2H4Br2��A�ĺ˴Ź���������ͼ1��ʾ����A�Ľṹ��ʽΪ_______��

��4��ij������Ľṹʽ������ʽ�������ģ����ͼ2�����л����ӵĺ˴Ź�������ͼ��ͼ3����λ��ppm�� �����й��ڸ��л����������ȷ����_______��

A. ���л��ﲻͬ��ѧ��������ԭ����8��
B. ���л������ڷ����廯��������ڷ�
C. ����ʽ�е�Et�����Ļ���Ϊ��CH3
D. ���л�����һ���������ܹ�������ȥ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��������������ý�����ȷ����
ѡ�� | ʵ����������� | ���� |
A | �ò�����պȡij��Һ������ɫ��Ӧʵ�飬����ʻ�ɫ | ��Һ�к���Na+ |
B | ��Ũ�Ⱦ�Ϊ0.1 mol��L-1��FeCl3��AlCl3�����Һ�еμ�NaOH��Һ�����ֺ��ɫ������ | Ksp[Fe(OH)3]��Ksp[Al(OH)3] |
C | �����£���pH��ֽ��ã�0.1 mol��L-1Na2CO3��Һ��pHԼΪ11��0.1 mol��L-1NaHCO3��Һ��pHԼΪ8�� | HCO3-���H+��������CO32-��ǿ |
D | ��Fe3+Ũ����ͬ��FeCl3��Һ��Fe2(SO4)3��Һ���ֱ���ϴ����������Ӧ���Թܣ�FeCl3��Һ��ϴ�øɾ� | ���ڿ�����̣� Fe3++Ag |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�����������(![]() )������(
)������(![]() )�����(
)�����(![]() )�ȣ����л��ϳ���Ӧ�ú��ձ飬Ŀǰ���л���ǿ�������о�Խ��Խ�ܵ���ע������Ϊ�л���ǿ��F�ĺϳ�·�ߣ�
)�ȣ����л��ϳ���Ӧ�ú��ձ飬Ŀǰ���л���ǿ�������о�Խ��Խ�ܵ���ע������Ϊ�л���ǿ��F�ĺϳ�·�ߣ�

��֪������Ϣ��
��H2C=CH2![]()
![]()
��![]() +RNH2
+RNH2![]()
![]()
�۱��������ऻ�Ϊ����ͬ���칹��
�ش��������⣺
(1)A�Ļ�ѧ����Ϊ________��
(2)��B����C�Ļ�ѧ����ʽΪ________��
(3)C�����������ŵ�����Ϊ________��
(4)��C����D�ķ�Ӧ����Ϊ________��
(5)D�Ľṹ��ʽΪ________��
(6)E����Ԫ������ͬ���칹���У���������Ʒ�Ӧ���Һ˴Ź�������������壬�����֮��Ϊ6��2��2��1����________�֣����У����㻷��Ϊ��ȡ���Ľṹ��ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1mol/L��K2SO4��Һ��0.2mol/L��Al2(SO4)3��Һ�ʹ�ˮ��ϣ�Ҫʹ���Һ��K+ ��Al3+�� SO42-��Ũ�ȷֱ�Ϊ0.1mol/L��0.1mol/L��0.2mol/L������ȡ���ߵ��������(�ٶ���Ϻ���������)( )
A��1:1:1 B��2:1:2 C��1:1:2 D��2:1:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Դ���������������Ź㷺��Ӧ�ã���ش��������⣺
��1���綯�������õ�Ǧ��������һ���������״̬ͭ��Ǧ�����һ��ṹ���Ƶij���������Ǧ��Ǧ����ɣ���H2SO4�����Һ���ŵ�ʱ�ܷ�ӦΪ��Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
�� д���ŵ�ʱ�����ĵ缫��Ӧʽ��______________________________��
�� Ǧ���طŵ�ʱ����Һ��pH��_________��������С�䣩�������·����0.5mol����ͨ��ʱ����Һ������H2SO4�����ʵ���Ϊ___________��
�� �ŵ���Ըõ�ؽ��г�磬�����ӵ�Դ�ĸ���һ������________��(����Pb������PbO2��)
��2����ͼ��ij����ɴ���ʹ�õ�����ȼ�ϵ�ء��䵼�����ΪKOH���ܷ�ӦΪ��2H2 + O2=2H2O��
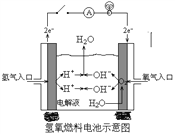
�� ��ͨ�����_______��(����H2������O2��)�����缫��ӦʽΪ��_______________________�������缫��ӦʽΪ��______________________��
����ѵ�����ʸ�ΪϡH2SO4����缫��ӦʽΪ������__________________������______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к͵ζ����ⶨij�ռ���Ʒ�Ĵ��ȣ��Ը���ʵ��ش��������⣺
��1��ȷ����8��2g�������������������ʵ���Ʒ�����500mL������Һ�� ��0��100mol![]() L-1����ζ���д�����кͷ�Ӧ���Ȼ�ѧ����ʽ____________(�к�����H����57��3 kJ/mol)�������ռ���Ʒ���500mL������Һ��Ҫ�IJ���������_________________________��
L-1����ζ���д�����кͷ�Ӧ���Ȼ�ѧ����ʽ____________(�к�����H����57��3 kJ/mol)�������ռ���Ʒ���500mL������Һ��Ҫ�IJ���������_________________________��
��3���ζ������У��۾�Ӧע��_________________�����÷�̪��ָʾ���ﵽ�ζ��յ���ɫ�仯��____________________________________��
��4�������±����ݣ����㱻���ռ���Һ�����ʵ���Ũ����_____molL-1���ռ���Ʒ�Ĵ�����____������С�������λ��
�ζ����� | ������Һ �����mL�� | ������� | |
�ζ�ǰ�Ŀ̶ȣ�mL�� | �ζ���Ŀ̶ȣ�mL�� | ||
��һ�� | 10��00 | 0��40 | 20��50 |
�ڶ��� | 10��00 | 4��10 | 24��00 |
��5������ʵ�������Եζ��������ʲô�����������ƫ������ƫ����������Ӱ������
�� �۲���ʽ�ζ���Һ��ʱ����ʼ���ӣ��ζ��յ�ƽ�ӣ���ζ����____��
�� ������ƿ�ô���Һ��ϴ��Ȼ���ټ���10��00mL����Һ����ζ����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᱻ��������֯Ʒ��Ư�ס���֯Ʒ���ữ��ë֯Ʒ��Ⱦɫ�����������ijɹ�����������ش������ʳ����ȡ�����ơ�Ѹ������������Ϊ���˵����Ṥҵ������˳����չ�ĵ�·��1874�꣬����е�������������й������Ǧ�ҷ�װ�ã�1876��Ͷ�����ղ�����Լ2t�����Ӵ������������ĺ��ķ�Ӧ�ǣ� 2SO2 +O2 2SO3����SO2�ڴ���������O2�Ӵ�����������Ӧ����ʾ��ͼ��ͼ��
2SO3����SO2�ڴ���������O2�Ӵ�����������Ӧ����ʾ��ͼ��ͼ��
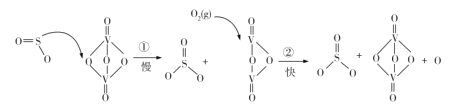
����˵����ȷ����
A.��Ӧ�ٵĻ�ܱȷ�Ӧ�ڵ�
B.�ܷ�Ӧ�ķ�Ӧ�����ɷ�Ӧ�پ���
C.ͼʾ�����м��� S��O ���Ķ��ѣ�����S��O�����γ�
D.�÷�Ӧ�Ĵ�����V2O5��V2O4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���������[Co(NH3)6]Cl3�dzȻ�ɫ�������Ǻϳ�����һЩ����������ԭ�ϡ����ú��ܷ���(������Fe��Al������)��ȡ[Co(NH3)6]Cl3�Ĺ���������ͼ���ش��������⣺
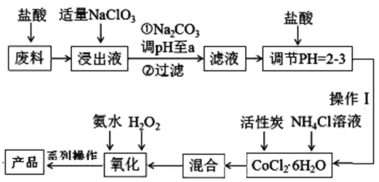
��֪����������Һ���к���Co2����Fe2����Fe3����Al3+��
��Ksp��Co(OH)2��=6��10-15��Ksp��Co(OH)3��=1.6��10-44
(1)��������NaClO3����������___��������Ӧ�����ӷ���ʽΪ___��
(2)����Na2CO3��pH��a�����������ֳ������ֱ�Ϊ___(�ѧʽ)��
(3)������IJ������___��___����ѹ���ˡ�
(4)������������������Ӧ�ȼ���___(������ˮ������H2O2��)����ˮԡ������50��60�棬�¶Ȳ��ܹ��ߣ�ԭ����___��д�������������跢����Ӧ�����ӷ���ʽ��___��������̿�����������ù�������г�[Co(NH3)6]Cl3����д������Ȼ�һ���就����[Co(NH3)5Cl]Cl2�����Ȼ��就һˮ����[Co(NH3)5H2O]Cl3���壬�������˴�����___�ԡ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com