
【题目】水的电离平衡曲线如图所示。
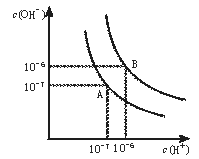
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从___增加到___。
(2)将100℃的pH=8的Ba(OH)2溶液与100℃的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为___。
(3)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)___。
A.9 B.13 C.11~13之间 D.9~11之间
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)___。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH-)减小
(5)室温下,如果将0.1molNH4Cl和0.05molNaOH全部溶于水,形成混合溶液(假设无损失),
①___和____两种粒子的物质的量之和等于0.1mol。
②___和___两种粒子的物质的量之和比OH-多0.05mol。
【答案】10-14 10-12 2:9 D C NH3·H2O NH4+ NH4+ H+
【解析】
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从10-7×10-7增加到10-6×10-6;
(2)设Ba(OH)2溶液的体积为V1,稀盐酸的体积为V2,则![]() ,由此可求出V1:V2,则可以计算出Ba(OH)2与盐酸的体积比;
,由此可求出V1:V2,则可以计算出Ba(OH)2与盐酸的体积比;
(3)在25℃条件下将pH=11的氨水稀释100倍后,由于氨水的电离度增大,所以10-5mol/L< c(OH-)<10-3mol/L,从而得出溶液的pH;
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是氯化铵电离生成的NH4+抑制氨水的电离,从而使氨水的电离平衡逆向移动;
(5)室温下,如果将0.1molNH4Cl和0.05molNaOH全部溶于水,形成混合溶液中,n(NH4Cl)=0.05mol,n(NH3·H2O)=0.05mol,n(NaCl)=0.05mol,在溶液中,存在下列两个电离平衡:NH3·H2O![]() NH
NH![]() + OH-,H2O
+ OH-,H2O![]() H++OH-;若假设电离的n(NH3·H2O)电离=x,则平衡后的溶液中,n(NH3·H2O)平=0.05-x,n(NH4+)=0.05+x,c(OH-) =x+ n(H+)。由此得出:
H++OH-;若假设电离的n(NH3·H2O)电离=x,则平衡后的溶液中,n(NH3·H2O)平=0.05-x,n(NH4+)=0.05+x,c(OH-) =x+ n(H+)。由此得出:
①NH3·H2O和NH4+两种粒子的物质的量之和等于0.1mol;
②NH4+和H+两种粒子的物质的量之和比OH-多0.05mol。
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从10-14增加到10-12;
答案为:10-14;10-12;
(2)设Ba(OH)2溶液的体积为V1,稀盐酸的体积为V2,则![]() ,由此可求出V1:V2=2:9,则Ba(OH)2与盐酸的体积比为2:9。答案为2:9;
,由此可求出V1:V2=2:9,则Ba(OH)2与盐酸的体积比为2:9。答案为2:9;
(3)在25℃条件下将pH=11的氨水稀释100倍后,由于氨水的电离度增大,所以10-5mol/L< c(OH-)<10-3mol/L,10-11mol/L< c(H+)<10-9mol/L,从而得出溶液的pH为9~11之间;
答案为:D;
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是氯化铵电离生成的NH4+抑制氨水的电离,从而使氨水的电离平衡逆向移动;
答案为:C;
(5)室温下,如果将0.1molNH4Cl和0.05molNaOH全部溶于水,形成混合溶液中,n(NH4Cl)=0.05mol,n(NH3·H2O)=0.05mol,n(NaCl)=0.05mol,在溶液中,存在下列两个电离平衡:NH3·H2O![]() NH
NH![]() + OH-,H2O
+ OH-,H2O![]() H++OH-。
H++OH-。
若假设电离的n(NH3·H2O)电离=x,则平衡后的溶液中,n(NH3·H2O)平=0.05-x,n(NH4+) =0.05+x,c(OH-) =x+ n(H+),由此得出:
①NH3·H2O和NH4+两种粒子的物质的量之和等于0.1mol;
答案为:NH3·H2O;NH4+;
②NH4+和H+两种粒子的物质的量之和比OH-多0.05mol;
答案为:NH4+;H+。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知:NO+NO2+2NaOH═2NaNO2+H2O;2NO2+2NaOH═NaNO3+NaNO2+H2O。将总体积共为40 mL的NO和O2两种气体分别同时通入同一足量的NaOH溶液中,完全反应后,溶液中只含有NaNO2和NaOH,剩余气体5 mL,则原混合气体中NO的体积为( )
A.20 mLB.25 mLC.12 mLD.33 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,Kb(NH3·H2O)=1.8×10-5,该温度下,用0.100mol·L-1的氨水滴定10.00mL0.100mol·L-1的一元酸HA的溶液,滴定过程中加入氨水的体积(V)与溶液中lg![]() 的关系如右图所示。下列说法不正确的是
的关系如右图所示。下列说法不正确的是

A. a=10 B. HA为强酸
C. 25℃时,NH4+的水解平衡常数为![]() ×10-9 D. 当滴入氨水的体积V=20mL时,溶液中存在c(NH4+)>c(A-)
×10-9 D. 当滴入氨水的体积V=20mL时,溶液中存在c(NH4+)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在密闭容器中SO2、O2、SO3三种气态物质建立化学平衡后,改变条件对反应2SO2(g)+O2(g)2SO3(g) ΔH<0的正、逆反应速率的影响如图所示:

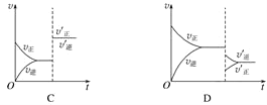
(1)加催化剂对反应速率影响的图象是__________(填字母,下同),平衡__________移动。
(2)升高温度对反应速率影响的图象是__________,平衡向__________方向移动。
(3)增大反应容器体积对反应速率影响的图象是__________,平衡向__________方向移动。
(4)增大O2的浓度对反应速率影响的图象是__________,平衡向__________方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系。一定条件下,A、B、C三种物质物质的量![]() 与时间
与时间![]() 的关系如图一所示,C的百分含量
的关系如图一所示,C的百分含量![]() 与温度
与温度![]() 的关系如图二所示。下列分析错误的是
的关系如图二所示。下列分析错误的是

A.![]() 时,A的平均反应速率为
时,A的平均反应速率为![]()
B.图二中![]() 、
、![]() 对应曲线上的点都处于化学平衡状态
对应曲线上的点都处于化学平衡状态
C.由![]() 向
向![]() 变化时,
变化时,![]()
D.该反应的正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
①单位时间内生成nmolO2的同时消耗2nmolNO2
②单位时间内生成nmolO2的同时消耗2nmolNO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A. ②④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到相应目的的是
A | B | C | D | |
目的 | 比较碳酸根与碳酸氢根水解程度 | 研究浓度对化学平衡的影响 | 比较不同催化剂对化学反应速率的影响 | 比较碳酸、醋酸和硼酸的酸性强弱 |
实验方案 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
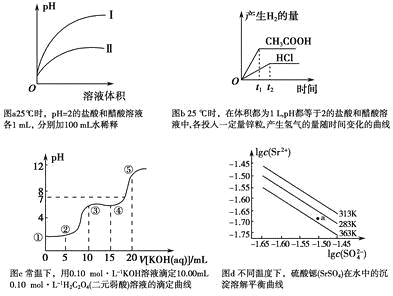
A.图a中,曲线Ⅱ表示醋酸溶液加100 mL水稀释的图像
B.图b中,可能各投入的锌粒颗粒大小相同且质量均为0.65 g
C.图c中,在①、②、③、④、⑤各点的溶液中所含阴离子种类不同
D.图d中,三个不同温度中,313 K时Ksp(SrSO4)最大;且283 K时,图中a点对应的溶液是不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将pH均为3,体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg![]() 的变化如图所示,下列叙述正确的是
的变化如图所示,下列叙述正确的是
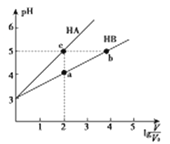
A. 水的电离程度:b>c>a
B. 若分别用等浓度的NaOH溶液完全中和,消耗NaOH的体积:b>a>c
C. 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:a>b>c
D. 溶液中离子总浓度: a>b>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com