
【题目】化学上常用燃烧法确定有机物的组成。下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
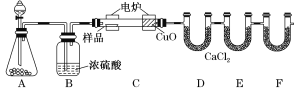
回答下列问题:
(1)A装置中盛放黑色固体分液漏斗盛放的物质是__________(名称)
(2)C装置(燃烧管)中CuO的作用是将有机物中的某元素充分氧化生成___________(化学式)
(3)写出E装置中所盛放试剂的名称__________,它的作用是吸收___________(化学式)。
(4)若将B装置去掉会使 __________(元素名称)元素的含量偏__________(大、小)
(5)若准确称取1.20 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的最简式为____________。
(6)要确定该有机物的化学式,还需要测定______________。
【答案】双氧水CO2碱石灰CO2氢大CH2O测出有机物的相对分子质量
【解析】
(1)根据实验原理可知装置A是制备氧气的,根据装置的特点可知A装置中分液漏斗盛放的物质是双氧水或水,应该反应的化学方程式是2H2O2![]() 2H2O+O2↑或2Na2O2+2H2O===4NaOH+O2↑;
2H2O+O2↑或2Na2O2+2H2O===4NaOH+O2↑;
(2)由于有机物在燃烧过程中,可能燃烧不充分,即有可能产生CO,而CO能与氧化铜反应生成铜和CO2,所以C装置(燃烧管)中CuO的作用是使有机物充分氧化生成CO2和H2O;
(3)由于有机物燃烧产生CO2,所以E装置的主要作用是吸收生成的CO2,因此其中所盛放试剂是碱石灰或氢氧化钠;
(4)B装置中盛有浓硫酸,其主要的作用是干燥氧气,除去水蒸气,因此如果将B装置去掉会造成测得有机物中含氢量增大,从而产生错误的结论;
(5)D管中无水氯化钙用来吸收水蒸气,质量增加0.72 g,则生成的水是0.72 g,m(H)=![]() ×2×1 g·mol-1=0.08 g;E管质量增加1.76 g,即CO2是1.76 g,m(C)=
×2×1 g·mol-1=0.08 g;E管质量增加1.76 g,即CO2是1.76 g,m(C)=![]() ×12 g·mol-1=0.48 g,所以根据质量守恒定律可知原有机物中氧元素的质量是1.20 g-0.08 g-0.48 g=0.64 g,所以原有机物中C、H、O的原子个数之比是
×12 g·mol-1=0.48 g,所以根据质量守恒定律可知原有机物中氧元素的质量是1.20 g-0.08 g-0.48 g=0.64 g,所以原有机物中C、H、O的原子个数之比是![]() ∶
∶![]() ∶
∶![]() =0.04∶0.08∶0.04=1∶2∶1,因此最简式是CH2O;
=0.04∶0.08∶0.04=1∶2∶1,因此最简式是CH2O;
(6)根据最简式要确定分子式,则还需要知道该物质的相对分子质量,所以要确定该有机物的化学式,还需要测出有机物的相对分子质量。


科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是( )
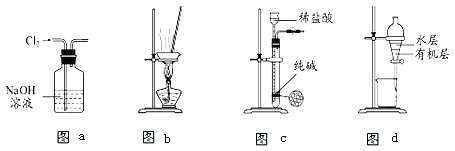
A. 用图(a)所示装置除去Cl2中含有的少量HCl
B. 用图(b)所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 用图(c)所示装置制取少量纯净的CO2气体并控制反应的发生和停止
D. 用图(d)所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语描述中不正确的是( )
A. 中子数为20的氯原子:![]()
B. K2O的电子式:![]()
C. HCO3﹣的电离方程式:HCO3﹣+H2O![]() CO32﹣+H3O+
CO32﹣+H3O+
D. 比例模型![]() 可以表示CO2分子或SiO2
可以表示CO2分子或SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH
CH3OH(g) ΔH

(1)根据图1请写出合成甲醇的热化学方程式_______________(热量用E1、E2或E3表示)。
(2)该反应的逆反应速率随时间变化的关系如上图2。t1时改变了某种条件,改变的条件可能是________________________。
(3)判断反应达到平衡状态的依据是____________(填字母序号)。
A.2v(H2)(逆) =v(CO)(正)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(4)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为___________。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是_____________(“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度__________(填“增大”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 盐酸和氨水反应H++OH=H2O、B. 钠和冷水反应Na+2H2O=Na++2OH+H2↑
C. 氯气和氢氧化钠溶液反应Cl2+2OH=Cl+ClO+H2OD. 铜和稀硝酸反应Cu+2NO3+4H+=2Cu2++2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
A.平衡时,v正(O2)=v逆(O2)必成立
B.关系式5v正(O2)=4v正(NO)总成立
C.用上述四种物质NH3、O2、NO、H2O表示的正反应速率的数值中,v正(H2O)最小
D.若投入4 mol NH3和5 mol O2,通过控制外界条件,必能生成4 mol NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
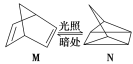 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M、N相比,较稳定的是 。
(2)已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式: 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 可用蒸发结晶的方法从碘水中提取碘单质
B. 碘化银可用于人工降雨
C. 酒精在实验台上着火可用水作灭火剂
D. 氢气还原氧化铜要先加热再通氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com