
| A. | 58 | B. | 173 | C. | 3 | D. | 128 |
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| C. | 硫化钠水溶液呈碱性的原因:S2-+2H2O?H2S↑+2OH- | |
| D. | 铝粉与NaOH溶液反应产生H2:2A1+2OH-+2H2O=2Al(OH)3↓+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构式为CH2=CH2 | |
| B. | CH2Cl2属于正四面体的空间结构 | |
| C. | 乙炔是含碳量最高的烃 | |
| D. | 正戊烷分子中所有碳原子一定不在同一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 结论 | |
| A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | 非金属性:Cl>C>S |
| B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO32-中的一种或几种 |
| C | 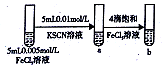 | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
| D | 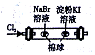 | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O2中所含H原子个数远大于2NA | |
| B. | 常温常压下,14.2g的Na2SO4和Na2S2O3的混合物含有Na原子个数为O.4NA | |
| C. | 标准状况下,1.5mol的MnO2粉末与足量浓盐酸共热转移电子数目小于3NA | |
| D. | 3.6gD2O所含质子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的原子半径比钠大,失电子能力不如钠 | |
| B. | 它的金属性比钠强,跟水反应会更剧烈 | |
| C. | 它的氢氧化物(FrOH)是一种强碱,遇酚酞溶液变红 | |
| D. | 它可与硫酸铜溶液反应,但是不易得到金属铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com