
| A. | 将AlCl3溶液加热蒸干可得无水AlCl3 | |
| B. | 用25ml碱式滴定管量出14.80ml的碳酸钠溶液 | |
| C. | 在中和滴定的实验过程中,目光只应注视滴定管的液面 | |
| D. | 用蒸馏水湿润过的pH试纸测0.1mol/L的醋酸溶液的pH值 |
分析 A.氯化铝水解生成氢氧化铝和氯化氢,加热促进氯化氢挥发,从而促进氯化铝水解,将溶液蒸干得到氢氧化铝固体,灼烧时氢氧化铝分解;
B.碳酸钠溶液显碱性,精确到0.01ml;
C.在中和滴定的实验过程中,目光应观察锥形瓶中溶液颜色的变化;
D.醋酸是弱酸存在电离平衡,用蒸馏水湿润过的pH试纸测定溶液PH会稀释溶液.
解答 解:A.氯化铝水解生成氢氧化铝和氯化氢,加热促进氯化氢挥发,从而促进氯化铝水解,将溶液蒸干得到氢氧化铝固体,灼烧时氢氧化铝分解生成氧化铝和水蒸气,所以得到的固体为Al2O3,故A错误;
B.碳酸钠溶液显碱性,精确到0.01ml,用25ml碱式滴定管量出14.80ml的碳酸钠溶液,故B正确;
C.在中和滴定的实验过程中,目光应观察锥形瓶中溶液颜色的变化,滴定管的读数是滴定完成后读取溶液体积,故C错误;
D.用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH,不能用水湿润pH试纸,否则稀释了醋酸溶液,测定溶液PH产生误差,故D错误;
故选B.
点评 本题考查了pH试纸的使用方法、盐类水解原理、滴定实验操作等知识,题目难度中等,注意掌握pH试纸的使用方法,明确溶液的酸碱性和溶液pH大小之间的关系是正确解题的关键.


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子序数:A>C>B>D | B. | 原子半径:B>D>C>A | ||
| C. | 原子序数:C>B>D>A | D. | 简单离子半径:D>B>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
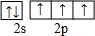 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 0.8 mol•L-1MgCl2溶液 | B. | 200 mL 0.4 mol•L-1AlCl3溶液 | ||
| C. | 50 mL 1.6 mol•L-1NaCl溶液 | D. | 25 mL 0.8 mol•L-1HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中既有物质变化又有能量变化 | |
| B. | 物质发生变化时,即使没有发生化学变化,也可能有能量的变化 | |
| C. | 任何化学反应中的能量变化都表现为放出热量或吸收热量 | |
| D. | 物质的化学能可以通过不同的变化方式转化为热能、电能等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
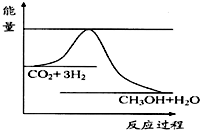 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在图所示物质的转化关系中,D在常温下为无色无味的液体(反应条件均已省略).请回答下列问题:
在图所示物质的转化关系中,D在常温下为无色无味的液体(反应条件均已省略).请回答下列问题: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com