
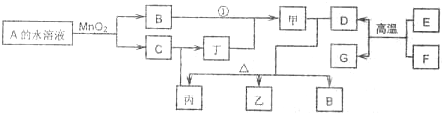
��֪�١��ܾ�Ϊ��ҵ������Ӧ�õij�����Ӧ�����г�����B��D��J��P���壬EΪ������ԭ�Ӹ�����Ϊ1��l��Һ�塣A����Է�������Ϊ120��(����Ӧ�IJ�������ȥ)

�Իش��������⣺
(1)A�Ļ�ѧʽΪ_____________ ����ҵ�Ϸ�Ӧ�����õ��豸������_____________��
(2)��Ӧ�ڵ�ʵ���У������õ���ҩƷ��_____________��_____________��
(3)��Ӧ�ܵĻ�ѧ����ʽΪ_____________��
�÷�Ӧװ����ʹ�������ӽ���Ĥ��������______________________________________
______________________________________________________��
(4)P��N��Ӧ�IJ���֮һ�ܺ�K����Һ������Ӧ���к��ɫ�������ɡ�д���ò���
��K�����ʵ�����1��2��Ӧ�����ӷ���ʽ��__________________________��
(5)������(![]() )������ҩ�Ⱦ�ϡ�������Լ�����Ҫԭ�ϡ��������з�Ӧ��ȡ��
)������ҩ�Ⱦ�ϡ�������Լ�����Ҫԭ�ϡ��������з�Ӧ��ȡ��
![]()
ijѧϰС����Ϊ����ҵ��Ϊ��߷�Ӧ���ʺ�![]() �IJ��ʣ��ɲ�ȡ�������ַ�����
�IJ��ʣ��ɲ�ȡ�������ַ�����
I����������![]()
���ø���
���������ʵ�ʶ��������ַ������м�Ҫ���ۣ�˵���Ƿ������ԭ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| 10-7b |
| a-b |
| 10-7b |
| a-b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
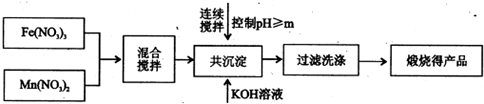
| ��ʼ���� | ��ȫ���� | |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
| ||
| x |
| 2 |
| 1 |
| 2 |
| a+b |
| x |
| 1 |
| 2 |
| a+b |
| x |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
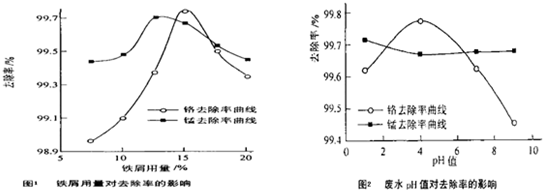
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com