
| A. | ①和②互为同分异构体,①和④互为同系物 | |
| B. | ④的一氯代物有三种 | |
| C. | ②不可能由烯烃与氢气加成而获得 | |
| D. | 能通过加氢反应得到③的炔烃有2种 |
分析 A.①和②分子式不同,不是同分异构体;
B.④中含有3种性质不同的H原子;
C.②中C与4个甲基成键,不可能为烯烃的加成产物;
D.炔烃中含有一个C≡C,发生加成反应生成的烷烃中相邻两个C各自至少含有2个H.
解答 解:A.①和②两个分子中C原子数不同,分子式不同,属于同系物,①和④分子式相同,结构不同,为同分异构体,故A错误;
B.④CH3CH2C(CH3)3中含有3种性质不同的H原子,则一氯代物有三种,故B正确;
C.②中C与4个甲基成键,不可能为烯烃的加成产物,故C错误;
D.炔烃中含有一个C≡C,发生加成反应生成的烷烃中相邻两个C各自至少含有2个H,CH3(CH2)2CH(CH3)2中左边开始第一、二两个碳,以及第二、三两个碳上可以形成碳碳三键,则能通过加氢反应得到③的炔烃有2种,故D正确;
故选BD.
点评 本题综合考查有机物的结构和性质,侧重于同系物、同分异构体的判断以及系统命名法等知识,题目难度不大,注意相关知识的积累.


科目:高中化学 来源: 题型:实验题
 某化学学习小组利用下列药品和实验装置测定镁铝合金中镁的质量分数.
某化学学习小组利用下列药品和实验装置测定镁铝合金中镁的质量分数.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2$\stackrel{HCl(ap)}{→}$SiCl4$\stackrel{H_{2}}{→}$Si | |
| B. | FeS2$→_{灼烧}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCl(aq)}{→}$NH4Cl(aq) | |
| D. | MgCO3$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,36g 水中所含的氧原子数目为2NA | |
| B. | 在标准状况下,22.4L三氧化硫的物质的量是1mol | |
| C. | 在标准状况下,0.1mol四氯化碳的体积为2.24L | |
| D. | 在标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mn(OH)2 | 7.1 | 10.1 |
| Cu(OH)2 | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
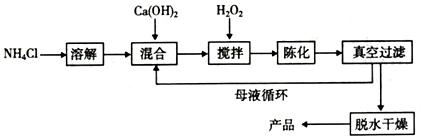
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com