
(15分)硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
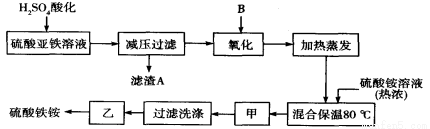
请回答下列问题:
(1)硫酸亚铁溶液加H2SO4酸化的主要目的是____________________________,滤渣A的主要成分是__________________。
(2)下列物质中最适合的氧化剂B是 ;反应的离子方程式 。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲、乙的名称分别是:甲______________,乙___________________。
(4)上述流程中,用足量最适合的氧化剂B氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,所加试剂为 (写名称),能否用酸性的KMnO4溶液? (如果能,下问忽略),理由是: 。(可用文字或方程式说明)
(5)检验硫酸铁铵中NH4+的方法是 。
(6)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入0.05 mol Ba (NO3)2溶液,恰好完全反应。则该硫酸铁铵的化学式为______________________。
(1)增大溶液中SO42-浓度,将Ca2+转化为沉淀,同时抑制Fe2+、 Fe3+水解;CaSO4.
(2)b;H2O2+2Fe2++2H+=2Fe2++2H2O
(3)冷却结晶;常温晾干
(4)铁氰化钾溶液;不能,因为过氧化氢和二价铁离子均能使酸性高锰酸钾溶液褪色
(5)在试管中加入少量样品和氢氧化钠固体加热,在试管口用湿润的红色石蕊试纸检验,看到试纸变成蓝色。(6)Fe2(SO4)3·2(NH4)2SO4·2H2O
【解析】
试题分析:(1)增大溶液中SO42-浓度,将Ca2+转化为沉淀,同时抑制Fe2+、 Fe3+水解;CaSO4.
(2)b是绿色氧化剂,而别的试剂都会引入新的杂质;H2O2+2Fe2++2H+=2Fe2++2H2O
(3)冷却结晶;常温晾干
(4)检验二价铁离子应该使用黄色的铁氰化钾K3〔Fe(CN)6〕溶液;二价铁离子与铁氰根离子反应生成带有特征蓝色的铁氰化亚铁沉淀:3Fe2++2〔Fe(CN)6〕3-=Fe3〔Fe(CN)6〕2↓;不能,因为过氧化氢和二价铁离子均能使酸性高锰酸钾溶液褪色
(5)在试管中加入少量样品和氢氧化钠固体加热,在试管口用湿润的红色石蕊试纸检验,看到试纸变成蓝色,则证明原溶液中含有氨根离子。
(6)14.00 g所得样品中,加入氢氧化钠得到2.14 g沉淀为氢氧化铁,所以
n(Fe)=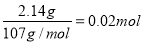
 向另一份溶液中加入0.05 mol Ba (NO3)2溶液,恰好完全反应生成硫酸钡沉淀。因此溶液中的硫酸根离子为0.05 mol ;也就是其中含有的Fe2(SO4)3为0.01 mol,(NH4)2SO4为0.02 mol ,此时质量为:0.01 mol ×400g/mol+0.02 mol ×132g/mol=6.64g,剩下的就是H2O的质量,那么每一份溶液中水的质量为:7.00g-6.64g=0.36g,n(H2O)=0.02 mol,因此该硫酸铁铵的化学式为:Fe2(SO4)3·2(NH4)2SO4·2H2O
向另一份溶液中加入0.05 mol Ba (NO3)2溶液,恰好完全反应生成硫酸钡沉淀。因此溶液中的硫酸根离子为0.05 mol ;也就是其中含有的Fe2(SO4)3为0.01 mol,(NH4)2SO4为0.02 mol ,此时质量为:0.01 mol ×400g/mol+0.02 mol ×132g/mol=6.64g,剩下的就是H2O的质量,那么每一份溶液中水的质量为:7.00g-6.64g=0.36g,n(H2O)=0.02 mol,因此该硫酸铁铵的化学式为:Fe2(SO4)3·2(NH4)2SO4·2H2O
考点: 考查物质的制备以及其铁离子的性质。


科目:高中化学 来源:2013-2014甘肃兰州一中高二下学期期末考试化学试卷(解析版) 题型:选择题
下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分
异构体的反应是
A.异戊二烯(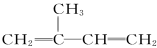 )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B.邻羟基苯甲酸与NaHCO3溶液反应
C.甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
D.2-氯丁烷与NaOH乙醇溶液共热发生消去反应
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃兰州一中高一下学期期末考试化学试卷(解析版) 题型:选择题
将2.5 mol A和1.25 mol B通入容积为1L的真空密闭容器中,经5s达到平衡状态。3A(g)+B(g)? ?pC(g)+2D(g),生成0.5 mol D,又知C的平均反应速率是0.1 mol/(L·s),则下列说法中正确的是
?pC(g)+2D(g),生成0.5 mol D,又知C的平均反应速率是0.1 mol/(L·s),则下列说法中正确的是
①A的转化率为20% ②B的转化率为25% ③A的平均反应速率为0.1mol/(L·s) ④方程式中p=2 ⑤B的平均反应速率为0.05mol/(L·s)
A. ①② B. ②③ C. ③④ D. ④⑤
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南长沙县一中、浏阳一中、宁乡一中高三5月化学试卷(解析版) 题型:填空题
(共14分)甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) | K3 |
|
|
(1)反应②是 (填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。
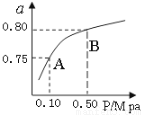
(3)判断反应③△H 0; △S 0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正) v(逆) (填“>”“=”或“<”)
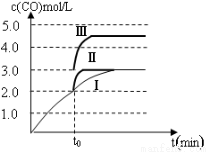
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,
将0.2 mol/L的乙酸与0.1 mol/LBa(OH)2溶液等体积混合,则混合溶液中离子浓度由大到小的顺序为
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南长沙县一中、浏阳一中、宁乡一中高三5月化学试卷(解析版) 题型:选择题
对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
A.
B.加入少量CH3COONa固体后,c(CH3COO—)降低
C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L
D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省长沙市高三高考二模理综化学试卷(解析版) 题型:选择题
关于下列各图的说法中,正确的是
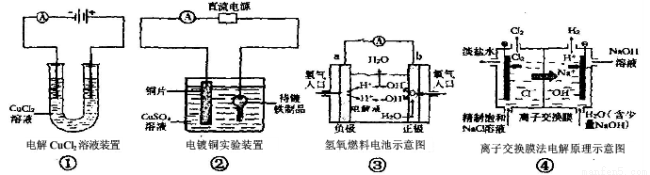
A.①中与电源负极相连的电极附近能产生使湿润淀粉KI试纸变蓝的气体
B.②中待镀铁制品应该与电源的正极相连接
C.③中的b极是电子流出的极,发生氧化反应
D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高二下学期期末考试化学试卷(解析版) 题型:填空题
i已知A是气态烃,完全燃烧时产生的CO2和H2O 的物质的量之比为1:1,A的相对分子质量小于30,在下图变化中,F为高分子化合物,C中含有-CHO,E有水果的香味(反应条件未写出)
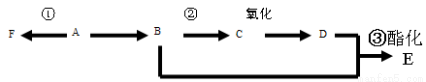
⑴ B中所含官能团名称 E 物质的名称
⑵ 反应①类型为
⑶ 写出下列反应的化学方程式(注明反应条件)
② ③
ⅱ 一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量为 g.
ⅲ有机物A可以通过不同化学反应分别制得B、C和D三种物质,结构简式如下图所示。
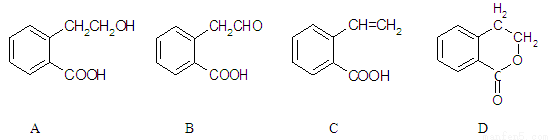
(1)B中的含氧官能团名称是 。
(2) A→C的反应类型是 ;A~D中互为同分异构体的是 。
(3)由A生成C的化学方程式是 。
(4)C在一定条件下发生加聚反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高二下学期期末考试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是( )
A.向盐酸中滴加氨水:H++OH-=H2O
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省益阳市高二上学期期末考试化学试卷(解析版) 题型:选择题
二惡英是一类物质的总称,这类物质的母体是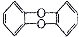 ,其中苯环上的氢原子如果被氯原子取代,所得到的物质的毒性是KCN的100倍。当有6个氯原子取代苯环上的氢原子时,所得的异构体数目是( )
,其中苯环上的氢原子如果被氯原子取代,所得到的物质的毒性是KCN的100倍。当有6个氯原子取代苯环上的氢原子时,所得的异构体数目是( )
A.7 B.9 C.10 D.11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com