
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。(提示:原子利用率=目标生成物的质量/参加反应的所有反应物的质量×100%),下列说法正确的是

A. ①→②吸收能量并形成了C―C键
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. 该催化剂可有效提高反应物的平衡转化率
D. 生成CH3COOH总反应的原子利用率小于100%
【答案】B
【解析】
A、根据图示,①的总能量高于②的总能量,①→②放出能量并形成C-C键;
B、CH4选择性活化变为①过程中,有1个C-H键发生断裂;
C、催化剂只影响化学反应速率,不影响化学平衡,不能提高平衡转化率;
D、生成 CH3COOH的总反应为CH4+CO2![]() CH3COOH,原子利用率为100%。
CH3COOH,原子利用率为100%。
A、根据图示,①的总能量高于②的总能量,①→②放出能量,对比①和②,①→②形成C-C键,选项A正确;
B、CH4选择性活化変为①过程中,有1个C-H键发生断裂,选项B正确;
C、催化剂只影响化学反应速率,不影响化学平衡,不能提高反应物的平衡转化率,选项C错误;
D、根据图示CH4与CO2在催化剂存在时生成 CH3COOH,总反应为CH4+CO2![]() CH3COOH,只有 CH3COOH一种生成物,原子利用率为100%,选项D正确;
CH3COOH,只有 CH3COOH一种生成物,原子利用率为100%,选项D正确;
答案选B。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】下列判断正确的是
A. 离子化合物中不可能含有共价键 B. 晶体中一定存在化学键
C. 碱性氧化物一定是金属氧化物 D. 直径介于1~10 nm之间的微粒称为胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
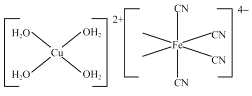
【题目】K4[Fe(CN)6]可用于生产油漆、药物等。
(1)Fe2+的核外电子排布式为_____。
(2)CN﹣中C原子轨道的杂化类型为_____。与CN﹣互为等电子体的一种分子的结构式为_____。
(3)[Cu(H2O)4]2+结构示意图如图所示。[Fe(CN)6]4﹣结构示意图如图所示,请在图中相应位置补填配体_________。
(4)已知3K4Fe(CN)6![]() 12KCN+Fe3C+3C+(CN)2↑+2N2↑.(CN)2分子中σ键与π键的数目比n(σ):n(π)=_____。
12KCN+Fe3C+3C+(CN)2↑+2N2↑.(CN)2分子中σ键与π键的数目比n(σ):n(π)=_____。
(5)铁触媒是合成氨反应的催化剂,其表面存在氮原子。氮原子在铁表面上的单层附着局部示意如图所示。则铁表面上氮原子与铁原子的数目比为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。广泛应用于钢铁、航空航天、能源、化工等领域。工业上常用钒炉渣(主要含FeOV2O3,还有少量SiO2、P2O5等杂质)提取V2O5的流程如图:

(1)焙烧的目的是将FeOV2O3转化为可溶性NaVO3,其中铁元素全部转化为+3价,写出该反应的化学方程式 _________________________________
(2)加MgSO4溶液的步骤中,滤渣的主要成分是_____________(用化学式表示)。
(3)沉钒过程中的发生反应的离子方程式为_________________,得到的固体物质往往需要洗涤,写出实验室洗涤NH4VO3沉淀的操作方法_______________。
(4)元素钒在溶液中还可以 以V2+(紫色)、V3+(绿色)、VO2+(蓝色)、VO2+(黄色)等形式存在.某利用钒元素微粒间的反应来设计的可充电电池的工作原理如图示,已知溶液中还含有1 mol 硫酸,请回答下列问题:

①充电时,左槽电极上发生的电极反应式为________________
②放电过程中,右槽溶液颜色变化为_______________________,若此时外电路转移了3.01×1022个电子,则左槽溶液中H+的变化量Δn(H+)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)置于一恒容密闭容器中,在不同温度下进行反应(已知该反应为放热反应)。实验记录得到下表中的两组数据:下列有关说法中不正确的是( )
实验序号 | 温度(℃) | 平衡常数(L/mol) | 起始量/mol | 平衡量/mol | 达到平衡所需时间(min) | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
A. 表中x=1.6;y=0.2B. 表中t>6
C. 表中K1、K2的关系:K2>K1D. 实验1在前6min的反应速率υ(SO2)=0.2mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g) ![]() N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) ![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) ![]() 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
以下说法正确的是
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
(1)氧化剂_____,还原剂_____;
(2)反应中转移电子数是_____;
(3)氧化剂与氧化产物的质量比_____;
(4)当生成2.8gN2时,被氧化的物质的质量是____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10 mL pH =1的CH3COOH 溶液加水稀释至100 mL后,溶液的pH为
A. 2 B. 2<pH<7 C. 1<pH<2 D. 无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com