
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
①分子式为C10H9O3 ②不能溶于水 ③1 mol该物质最多能与4 mol H2加成 ④能使酸性KMnO4溶液褪色 ⑤1 mol该物质最多能与含2 mol NaOH的溶液反应
A.①②③ B.③④⑤
C.②③④ D.②③④⑤
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
提示下列信息
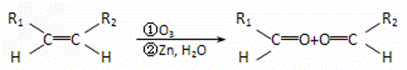
某无支链的环状一氯代烃A(分子式为C6H11Cl)可发生如下转化关系:
 |
试回答下列问题:
(1)A的结构简式为__________,
(2)指出下列转化的反应类型:C→D: ________________________
(3)写出D→E的化学方程式:___________________________________________
(4)A的链状同分异构体有多种。各写出符合下列条件的一种同分异构体的结构简式。
①只有一个甲基:______________________________________________
②有3个甲基,但不存在顺反异构体:__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
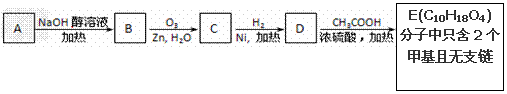
已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平。E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。

(1)A的结构式为__________,C的名称为__________。(2分)
(2)B分子中的官能团名称是_________,请设计一种验证B物质存在该官能团的方法______________________________________________________________。(2分)
(3)写出下列反应的化学方程式并指出反应类型:(4分)
①__________________________________________;反应类型是_____________;
④__________________________________________;反应类型是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
L、M、R、T、W是原子序数依次增大的短周期主族元素,M、T在周期表中的相对位置如右表;L与R原子的最外层电子数相同,R的单质是一种常见的半导体材料。请回答下列问题:
| M | |
| T |
(1)T原子的结构示意图为________,元素W在周期表中位于第____________族,M单质分子的电子式为________。
(2)R是组成玻璃的元素之一,不能用带磨口玻璃塞的试剂瓶盛放氢氧化钠溶液的原因是(用化学方程式表示)________________________________________ _______________
________________________________________________________________________。
(3)下列有关相应元素非金属性强弱比较的说法,正确的是(填序号)________。
a.M的气态氢化物比R的气态氢化物稳定,则非金属性M强于R
b.高温下,L的单质能从R的最高价氧化物中置换出R,则非金属性L强于R
c.W的核电荷数比T多,原子半径比T小,得电子能力强,则非金属性W强于T
d.同温、同物质的量浓度的Na2LO3和Na2TO4溶液的pH:Na2LO3>Na2TO4,则非金属性T强于L
(4)工业上可用二氧化硅、氯气和焦炭在高温条件下制备RW4,该反应中除RW4外的另一种产物可用于工业炼铁。制备RW4的化学方程式为__________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关系正确的是( )
A.熔点:戊烷>2,2二甲基戊烷>2,3二甲基丁烷>丙烷
B.密度:CCl4>CHCl3>H2O>苯
C.含氢量:甲烷>乙烷>乙烯>乙炔>苯
D.同物质的量物质燃烧耗O2量:己烷>环己烷>苯>苯甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物A由C、H、O三种元素组成,相对分子质量为90。将9.0 g A完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g。A能与NaHCO3溶液发生反应,且2分子A之间脱水可生成六元环化合物。有关A的说法正确的是( )
A.分子式是C3H8O3
B.A催化氧化的产物能发生银镜反应
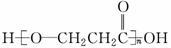 C.0.1 mol A与足量Na反应产生2.24 L H2(标准状况)
C.0.1 mol A与足量Na反应产生2.24 L H2(标准状况)
D.A在一定条件下发生缩聚反应的产物是
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制取少量溴乙烷的装置如下图所示。根据题意完成下列填空:
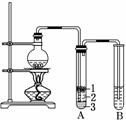
(1)圆底烧瓶中加入的反应物是溴化钠、________和1∶1的硫酸。配制体积比1∶1的硫酸所用的定量仪器为________(选填编号)。
a.天平 b.量筒
c.容量瓶 d.滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式
________________________________________________________________________
________________________________________________________________________。
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是________________。试管A中的物质分为三层(如图所示),产物在第________层。
(4)试管A中除了产物和水之外,还可能存在________、________(写出化学式)。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是________(选填编号)。
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是________。
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物M是一种治疗心脏病的中间体,以A为原料的工业合成路线如下图所示:
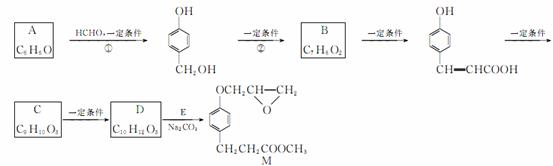
已知:RONa+R′Cl→ROR′+NaCl。
根据题意完成下列填空:
(1)写出反应类型:反应①____________;反应②____________。
(2)写出结构简式:A__________________________;
C__________________________。
(3)写出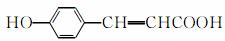 的邻位异构体分子内脱水生成香豆素的结构简式:
的邻位异构体分子内脱水生成香豆素的结构简式:
________________________________________________________________________。
(4)由C生成D的另一个反应物是________,反应条件是
____________________________ _
_ ___________________________________________。
___________________________________________。
(5)写出由D生成M的化学方程式:
________________________________________________________________________
________________________________________________________________________。
(6)A也是制备环己醇(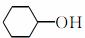 )的原料,写出检验A已完全转化为环己醇的方法。
)的原料,写出检验A已完全转化为环己醇的方法。
________________________________________________________________________
_____________________________________________________ ___________________。
___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中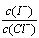 为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(4)Bodensteins研究了下列反应:
2HI(g) H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
① 根据上述实验结果,该反应的平衡常数K的计算式为:___________。
② 上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=__________min-1
③ 由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重 新达到平衡,相应的点分别为_________________(填字母)
新达到平衡,相应的点分别为_________________(填字母)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com