
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
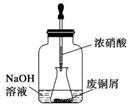
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓硝酸缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70 ℃左右,用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式_____________________________________
________________________________________________________________________。
(2)上图装置中NaOH溶液的作用是__________________________________
________________________________________________________________________。
(3)步骤二中,水浴加热所需仪器有________、________(加热、夹持仪器、石棉网除外),水浴加热的优点是________________________________________________
________________________________________________________________________。
(4)若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是________。
答案 (1)Cu+4H++2NO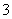 ===Cu2++2NO2↑+2H2O
===Cu2++2NO2↑+2H2O
(2)吸收氮氧化物
(3)烧杯 温度计 受热均匀,温度易于控制
(4)91.74%
解析 (1)铜与浓硝酸反应生成NO2,其离子方程式为Cu+4H++2NO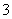 ===Cu2++2NO2↑+2H2O。
===Cu2++2NO2↑+2H2O。
(2)NO2有毒,可与氢氧化钠溶液反应生成硝酸盐和亚硝酸盐。
(3)水浴加热可使被加热物体受热均匀,且温度易于控制。水浴加热所需仪器除了热源、夹持仪器、石棉网外,还必须有烧杯、温度计。
(4)Cu2(OH)2CO3分解反应方程式为Cu2(OH)2CO3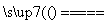 2CuO+CO2↑+H2O,用差量法求解
2CuO+CO2↑+H2O,用差量法求解
Cu2(OH)2CO3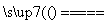 2CuO+CO2↑+H2O Δm
2CuO+CO2↑+H2O Δm
222 160 62
m 2.42 g-1.80 g
=0.62 g
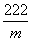 =
=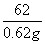
解得m=2.22 g
样品中碱式碳酸铜的质量分数=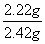 ×100%≈91.74%。
×100%≈91.74%。


科目:高中化学 来源: 题型:
在化学反应中,反应前与反应后相比较,肯定不变的是 ( )。
①元素的种类 ②原子的种类 ③分子的数目 ④原子的数目 ⑤反应前物质的质量总和与反应后物质的质量总和 ⑥如果在水溶液中反应,反应前与反应后阳离子所带的正电荷总数
A.①②③④ B.①②⑤⑥
C.①②④⑤ D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
A.所得溶液中c(H+)=1.0×10-13 mol·L-1
B.所得溶液中由水电离产生的c(OH-)=1×10-13 mol·L-1
C.所加烧碱溶液的pH=13.0
D.所得溶液中c(Mg2+)=5.6×10-10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列晶体熔沸点由高到低的顺序正确的是( )
①SiC ②Si ③HCl ④HBr ⑤HI ⑥CO ⑦N2 ⑧H2
A.①②③④⑤⑥⑦⑧ B.①②⑤④③⑥⑦⑧
C.①②⑤④③⑦⑥⑧ D.⑥⑤④③②①⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子的外围电子排布式为 。
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 。
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③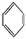 、④HCHO,其中碳原子采取sp2杂化的分子有
、④HCHO,其中碳原子采取sp2杂化的分子有
(填物质序号),HCHO分子的立体结构为 形。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 。
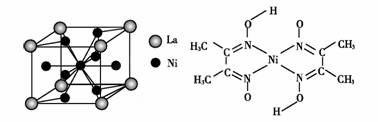
(5)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如右上图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化亚铜(CuCl)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇,在工业上应用广泛。工业上制取氯化亚铜的工艺流程如下:
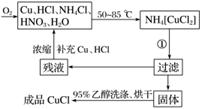
实验药品:铜丝20 g、氯化铵20 g、65%硝酸10 mL、36%盐酸15 mL、水。
(1)反应①的化学方程式为________________________________________________,
用95%乙醇代替蒸馏水洗涤的主要目的是____________________________________________
________________________________________________________________________(写出一条即可)。
(2)工业化生产时,95%乙醇可通过__________的方法回收并循环利用,而NH4Cl、____________(填化学式)可直接循环利用。
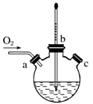
(3)实验室用右图装置制备CuCl。
①实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,最宜选择下列装置中的________(填字母)。
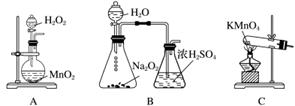
②实验开始时,温度计显示反应液温度低于室温,主要原因是________________________________________________________________________
________________________________________________________________________。
电炉加热升温至50 ℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色,从环保角度考虑,当______________________________时才能停止通入氧
气;待冷却至室温后,再打开瓶塞,沿________(填字母)口倾出棕色反应液于1 000 mL大烧杯中,加水500 mL,即有大量白色沉淀析出。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2===2NO,经测定前3 s用N2表示的反应速率为0.1 mol·L-1·s-1,则6 s末NO的浓度为
A.1.2 mol·L-1 B.大于1.2 mol·L-1
C.小于1.2 mol·L-1 D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30%H2O2,0.1 mol·L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。
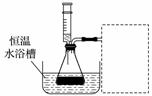
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:________________________________________________________________________。
②设计实验方案:在不同H2O2浓度下,测定________________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成上图的装置示意图。
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
| 物理量 实验序号 | V[0.1 mol·L-1 Fe2(SO4)3]/mL | …… | |
| 1 | a | …… | |
| 2 | a | …… |
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中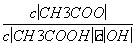 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com