
【题目】下列关于同分异构体判断正确的是
A. 甲苯的一氯代物有4种
B. 分子式为C8H10的芳香烃有3种
C. 分子式为C4H8的烯烃同分异构体有2种,分别为CH2=CHCH2CH3、CH3CH=CHCH3
D. 二氯甲烷有两种同分异构体
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变),下列说法正确的是( )

A.右边CO和CO2分子数之比为1:3
B.右边CO的质量为42g
C.右边气体密度是相同条件下氧气密度的2倍
D.若改变右边CO和CO2的充入量而使隔板处于距离右端![]() 处,若保持温度不变,则前后两次容器内的压强之比为5:6
处,若保持温度不变,则前后两次容器内的压强之比为5:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下非金属氧化物与其引起的环境问题及主要来源对应正确的是
选项 | 氧化物 | 环境问题 | 主要来源 |
A | CO2 | 破坏臭氧层 | 化石燃料的燃烧 |
B | SO2 | 温室效应 | 汽车尾气的排放 |
C | NO2 | 光化学烟雾 | 工厂废气的排放 |
D | CO | 酸雨 | 汽车尾气和化石燃料的不完全燃烧 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 25mL 的氢氧化钠溶液中逐滴加入 0.2 mol/ L 醋酸溶液,滴定曲线如图所示。

(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式___________________
(2)该氢氧化钠溶液浓度为______________
(3)在B点,a____12.5mL(填“>”“<”或“=”)。若由体积相等的氢氧化钠溶液和醋酸溶液混合恰好中性,则混合前c(NaOH)____c(CH3COOH),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)____c(OH-)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、在528K、固定计提的容器中,反应CO(g)+2H2(g)CH3OH(g)过程中能量变化如图所示,曲线Ⅱ表示使用催化剂时的能量变化,若投入a molCO、2amolH2,平衡时能生成0.1amolCH3OH,反应就具工业应用价值。
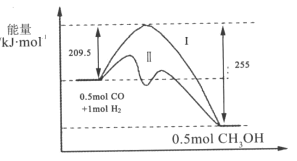
(1)该反应的热化学方程式为______;
(2)若按上述投料比使该反应具有工业应用价值,CO的平衡转化率为______;
(3)在容器容积不变的前提下,欲提高H2的转化率,可采取的措施______;(答出两项即可)
(4)关于反应历程Ⅰ与反应历程Ⅱ相比较,下列说法正确的是______;
A.反应历程Ⅱ比反应历程Ⅰ放出的热量少
B.反应历程Ⅱ比反应历程Ⅰ反应速率快
C.反应历程Ⅱ比反应历程Ⅰ平衡常数小
D.反应历程Ⅱ和反应历程Ⅰ中CO转化率相同
Ⅱ、已知:N2(g)+3H2(g)2NH3(g)△H=-92.1kJ/mol,在容器中充入1.4mol/LN2与4 mol/LH2,其中N2与NH3在达到平衡后改变某条件下的浓度变化如图所示
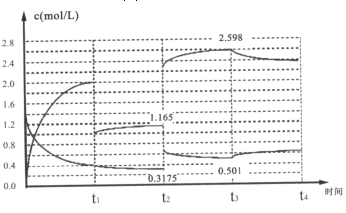
(5)t2时刻改变的条件为______;
(6)t2=t3时刻的平衡常数为______(mol/L)-2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬[(CH3COO2CrH2O)]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在密闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示。回答下列问题

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是______;仪器b的名称是______。
(2)连通管a的作用是______;装置丙的作用是______。
(3)将过量锌粒和氯化铬固体置于b中,加入少量蒸馏水,按图连接好装置。打开K1、K3,关闭K2。
①b中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为______;
②同时b中有气体产生,该气体的作用是______。
(4)欲使b中亮蓝色溶液流入乙,在乙中析出砖红色沉淀,接下来的操作为打开______,关闭K3和______。其原因是______。
(5)该实验中盐酸必须适量,不能过量的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃结构简式为 ,其命名正确的是
,其命名正确的是
A. 2-乙基-3,3-二甲基戊烷 B. 3,3-二甲基-4-乙基戊烷
C. 3,3,4-三甲基己烷 D. 3,4,4-三甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为纳米二氧化锰燃料电池,其电解质溶液呈酸性,已知(CH2O)n中碳的化合价为0价,有关该电池的说法正确的是

A. 放电过程中左侧溶液的pH降低
B. 当产生22gCO2时,理论上迁移质子的物质的量为4mol
C. 产生22gCO2时,膜左侧溶液的质量变化为:89g
D. 电子在外电路中流动方向为从a到b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是很好的净水剂,高铁酸钡( BaFeO4)是高能电池阳极的优良材料。已知:K2FeO4为紫色固体,微溶于KOH溶液,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定;在碱性溶液中,NaCl、NaNO3、K2FeO4的溶解性都小于Na2FeO4;BaFeO4难溶于水和碱性溶液。某化学兴趣小组欲制取“84”消毒液,进而制取少量K2FeO4和 BaFeO4。请回答下列问题:
(实验一)选择合适的仪器和试剂制取氯气,进而制备高浓度的“84”消毒液。

(1)选择合适的仪器,导管接口正确的连接顺序为___________;所选装置(A或B)中发生反应的离子方程式为______________________。
(实验二)用“84”消毒液制取K2FcO4
实验步骤:①用如图所示装置(夹持仪器略去)使反应物充分反应;②用砂芯漏斗对烧杯中的溶液进行抽滤,向滤液中慢慢加入KOH溶液;③再用砂芯漏斗对步骤②的最后反应混合物进行抽滤,并用苯、乙醚洗涤沉淀,真空干燥后得K2FeO4。

(2)写出步骤①中物质在20℃冷水浴中发生反应的化学方程式:______________________。
(3)步骤②中能够发生反应的原因是______________________,步骤③中不用水,而用苯、乙醚洗涤沉淀的目的是_________________________________。
(实验三)将上述产品配成K2FeO4碱性溶液,再慢慢加入Ba(OH)2溶液,抽滤得 BaFeO4。
(4)若投入ag硝酸铁晶体,得到bg高铁酸钡,则高铁酸钡的产率是___________。[已知Fe(NO3)3·9H2O的摩尔质量为404g·mol-1, BaFeO4的摩尔质量为257g·mol-1]
(实验四)利用如图所示电解装置也可以制得 BaFeO4。

(5)在___________(填“阳极区”或“阴极区”)可得到高铁酸钡,阳极的电极反应式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com