
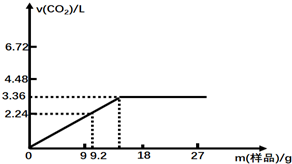
分析 (1)开始时发生反应的离子方程式为:HCO3-+H+=H2O+CO2↑,所以盐酸的物质的量与二氧化碳的物质的量相等,结合c=$\frac{n}{V}$计算求解;
(2)根据图示可知,当固体质量为9.2g时盐酸过量,碳酸氢钠和碳酸氢钾完全反应,根据固体质量和二氧化碳的量列出二元一次方程组进行计算.
解答 解:(1)开始时发生反应的离子方程式为:HCO3-+H+=H2O+CO2↑,所以盐酸的物质的量与二氧化碳的物质的量相等,所以50mL中盐酸有物质的是量为:$\frac{3.36}{22.4}$=0.15mol,结合c=$\frac{n}{V}$=$\frac{0.15}{0.05}$=3mol/L,故答案为:3;
(2)当固体质量为9.2g时盐酸过量,碳酸氢钠和碳酸氢钾完全反应,
设NaHCO3为的物质的量为xmol、KHCO3为ymol,
根据混合物质量可得:①84x+100y=9.2,
根据生成二氧化碳的物质的量,利用碳原子守恒可得:②x+y=$\frac{2.24L}{22.4L/mol}$=0.1,
根据①②解得:x=y=0.05,混合物样品中,NaHCO3与KHCO3的物质的量之比1:1,
故答案为:1:1.
点评 本题考查了有关混合物反应的计算,题目难度中等,正确分析图象中曲线变化的含义为解答关键,注意掌握质量分数的概念及表达式,试题侧重考查学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| B. | “煤改气”“煤改电”等清洁燃料改造工程有利于减少雾霾天气 | |
| C. | 利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染 | |
| D. | 焰火的五彩缤纷是某些金属元素化学性质的展现 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X的常见氢化物水溶液显弱碱性 | |
| B. | 组成为HZO的物质结构式为H-Z-O | |
| C. | 最高价氧化物对应水化物酸性:Z>X>Y | |
| D. | 简单离子半径:Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA | |
| B. | 1mol镁与足量O2或N2反应生成MgO或Mg3N2失去电子分别为2NA和3NA | |
| C. | 含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 某密闭容器中盛有0.2molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾和镁的次外层电子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 等体积的CO和NO含有的原子数 | |
| D. | 等物质的量的钠分别在常温下和点燃条件下与氧气反应转移的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
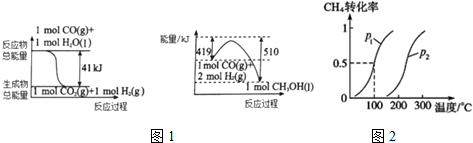
| 2min | 5min | 10min | |
| CO | 0.07 | 0.06 | 0.05 |
| H2 | 0.14 | 0.12 | 0.20 |
| CH3OH | 0.03 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
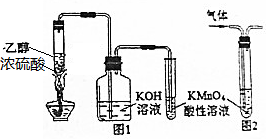
| A. | 用图1所示装置制取乙烯并验证其某些性质 | |
| B. | 用图2装置除去甲烷中的乙烯 | |
| C. | 在坩埚中灼烧CuSO4•5H2O晶体以除去结晶水 | |
| D. | 0.5g淀粉、5mL20%H2SO4和5mL蒸馏水混合,加热5min后冷却,然后向其中加入新制银氨溶液,水浴加热,无银镜反应,说明淀粉没有水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com