
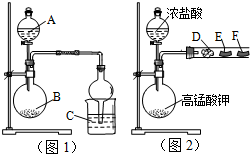
 某研究性学习小组设计了两组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.图2中,D、E、F三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸条.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
某研究性学习小组设计了两组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.图2中,D、E、F三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸条.已知常温下浓盐酸与高锰酸钾能反应生成氯气.分析 (1)根据信息知道:甲同学根据元素非金属性与对应最高价含氧酸之间的关系如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较,根据强酸制弱酸来回答即可;图1烧杯中为二氧化碳与硅酸钠反应;
(2)根据氧化性强的单质可以将氧化性弱的单质从其盐中置换出来结合反应产物确定实验现象.
解答 解:(1)根据题干信息:甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究,硝酸的酸性强于碳酸,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则原子的非金属性越强,所以A为稀硝酸,B为碳酸钙或碳酸钡,C为硅酸钠或硅酸钾溶液,图1烧杯中为二氧化碳与硅酸钠反应生成硅酸沉淀和碳酸钠,其反应的离子方程式为:SiO3+CO2+H2O═H2SiO3↓+CO32-;
故答案为:稀硝酸;碳酸钙或碳酸钡;SiO3+CO2+H2O═H2SiO3↓+CO32-;
(2)根据题干信息:乙同学设计了如图2装置来验证卤族元素性质的递变规律,所以乙同学的实验原理是同主族单质氧化性越强阴离子还原性越弱,对应元素非金属越强,高锰酸钾和浓盐酸反应会产生氯气,反应方程式为:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,氯气具有氧化性,能将溴离子、碘离子氧化为对应的单质,即D处:Cl2+2Br-=2Cl-+Br2,E:Cl2+2I-=2Cl-+I2,所以E处的现象变蓝,剩余的氯气能使湿润红纸褪色,即F处的现象是红色褪色,
故答案为:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O; 变蓝色; 红色褪色.
点评 本题将元素及其化合物、元素周期律与非金属性强弱比较的实验设计结合起来,具有较强的综合性,有一定的难度,注意实验设计的原理和方法.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
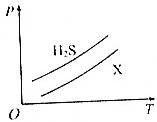 如图所示,表示1 g H2S与1g X气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能是( )
如图所示,表示1 g H2S与1g X气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能是( )| A. | N2 | B. | CH4 | C. | NO | D. | SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用碱石灰来干燥SO2气体 | |
| B. | 通入BaCl2溶液中,无明显现象 | |
| C. | 因为SO2有漂白性,所以它能使品红溶液、溴水褪色 | |
| D. | 将1.12L的SO2气体通入装有100mL 1mol/L的FeCl3溶液的试管里,恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧-18的原子符号:${\;}_{8}^{18}$O | B. | CO2分子的结构式:O═C═O | ||
| C. | 次氯酸的电子式: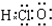 | D. | S2-的结构示意图: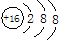 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C8H10的芳香化合物有3种可能的不同结构 | |
| B. | 分子式为C4H9Cl的有机物有3种可能的不同结构 | |
| C. | 分子式为C4H8属于烯烃的有机物有3种可能的不同结构 | |
| D. | 分子式为C5H12的有机物有4种可能的不同结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
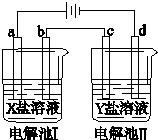
| A. | 若a是Zn,X是ZnSO4,则构成电镀池 | |
| B. | 当Y是硫酸铜,要构成电解精炼铜,则c是粗铜,d是精铜,且电解过程中硫酸铜溶液浓度不变 | |
| C. | 当X是CuCl2,Y是Na2SO4,用惰性电极电解,在I、II电解池中产生的气体物质的量之比为2:3 | |
| D. | 若去除电源,把b和c换成盐桥,可能构成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4<HBrO4<HIO4 | B. | 碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2 | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 氧化性:I2>Br2>Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com