
【题目】下列离子反应方程式书写正确的是
A.往稀盐酸中逐滴加入Na2CO3溶液,开始时:H++CO![]() =HCO
=HCO![]()
B.草酸(H2C2O4,弱酸)溶液中加入酸性KMnO4溶液: 2MnO![]() +5C2O
+5C2O![]() +16H+=2Mn2++10CO2↑+8H2O
+16H+=2Mn2++10CO2↑+8H2O
C.往少量澄清石灰水中加入Ca(HCO3)2溶液: Ca2++OH-+HCO![]() =CaCO3↓+H2O
=CaCO3↓+H2O
D.用HI溶液溶解Fe2O3固体:Fe2O3+6H+=2Fe3++3H2O
【答案】C
【解析】
A. 往稀盐酸中逐滴加入Na2CO3溶液,开始时盐酸过量,氢离子浓度较大,反应生成水和二氧化碳,反应的离子方程式为:2H++CO![]() =H2O+CO2↑,选项A错误;
=H2O+CO2↑,选项A错误;
B. 草酸为弱酸,必须写化学式,故草酸(H2C2O4)溶液中加入酸性KMnO4溶液,反应的离子方程式为: 2MnO![]() +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,选项B错误;
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,选项B错误;
C. 往少量澄清石灰水中加入Ca(HCO3)2溶液,反应生成碳酸钙和水,反应的离子方程式为:Ca2++OH-+HCO![]() =CaCO3↓+H2O,选项C正确;
=CaCO3↓+H2O,选项C正确;
D. 用HI溶液溶解Fe2O3固体,反应生成碘化亚铁、碘和水,反应的离子方程式为:Fe2O3+6H++2I-=2Fe2++3H2O+I2,选项D错误;
答案选C。


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值,下列叙述正确的是( )
表示阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,![]() 含有的氧原子数为3 NA
含有的氧原子数为3 NA
B.标准状况下,![]() 与足量的
与足量的![]() 反应转移的电子数为3 NA
反应转移的电子数为3 NA
C.NA个一氧化碳分子和![]() 甲烷的质量比为7:4
甲烷的质量比为7:4
D.![]() 固体溶于1L的水中,所得溶液的物质的量浓度为
固体溶于1L的水中,所得溶液的物质的量浓度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料的发展与应用促进了人类社会的进步
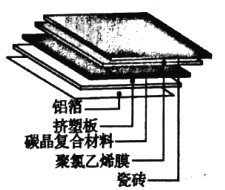
(1)碳晶地暖环保、节能、安全,其构造如图所示。其中属于金属材料的是_____;属于硅酸盐材料的是____;属于高分子材料的是挤塑板和______
(2)吸附材料具有多孔、表面积大的特点,活性炭吸附![]() 的过程中,会伴有C与
的过程中,会伴有C与![]() 的反应,产物为两种常见无毒气体.写出该反应的化学方程式:_____________
的反应,产物为两种常见无毒气体.写出该反应的化学方程式:_____________
(3)![]() 是锂离子电池的一种正极材料,可通过
是锂离子电池的一种正极材料,可通过![]() 与
与![]() 煅烧制备,同时还生成
煅烧制备,同时还生成![]() 和一种单质,写出该反应的化学方程式:________
和一种单质,写出该反应的化学方程式:________
(4)某原电池装置如图所示:
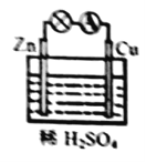
①负极的电极反应式是_______;
②当铜表面析出![]() 氢气(标准状况)时,导线中通过了____
氢气(标准状况)时,导线中通过了____![]() 电子
电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,其沸点为-5.5℃,易水解。已知:AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3 +HNO2,某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。
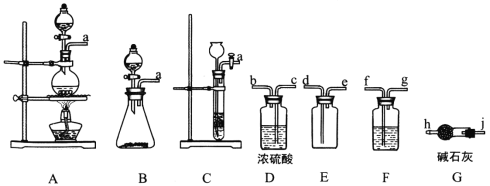
(1)制备Cl2的发生装置可以选用___________(填字母代号)装置,发生反应的化学方程式为_______________________________________________。
(2)欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 A→_______→_______→________→_______ (按气流方向,用装置的大写字母表示)。
(3)实验室可用图示装置制备亚硝酰氯:
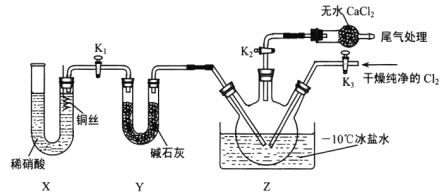
①实验室也可用 B装置制备NO,与B装置相比 X装置的优点为____________。
②检验装置气密性并装入药品,打开K2,然后再打开K3,通入一段时间气体,其目的是______,然后打开K1,当Z中有一定量液体生成时,停止实验。
(4)已知:ClNO 与H2O反应生成HNO2和 HCl。通过以下实验测定ClNO样品的纯度。取Z中所得液体m g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用c molL-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是____,亚硝酰氯(ClNO)的质量分数为_____。(已知:Ag2CrO4为砖红色固体; Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二草酸合铜酸钾晶体{K2[Cu(C2O4)2]·2H2O)(相对分子质量为354),微溶于水和酒精,可溶于氨水,在干燥的环境下较为稳定。现以胆矾和草酸(H2C2O4)为原料制备二草酸合铜酸钾晶体的流程如下:
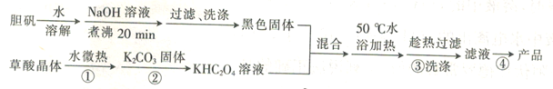
回答下列问题:
(1)K2[Cu(C2O4)2]·2H2O中Cu的化合价为___________。
(2)在常温下,胆矾溶液与氢氧化钠溶液反应生成氢氧化铜,当所得溶液的pH=7时,则溶液中c(Cu2+)=_________{已知该温度下Ksp[Cu(OH)2]=2.2×10-20}。
(3)黑色固体的化学式为__________________,过滤时用到的玻璃仪器有漏斗、__________。
(4)草酸晶体受热易分解,产物为CO、CO2和H2O,该反应的化学方程式为_____________。
(5)操作④后得到的晶体需用少量酒精洗涤,其目的是_________。
(6)产品的定量准确称取2.000 g样品溶于氨水中,并配成250 mL溶液,量取25.00 mL溶液于锥形瓶中,再加入10 mL 3.000 mol·L-1稀硫酸,用0.01000 mol·L-1KMnO4标准液滴定。
①若消耗KMnO4标准液的体积为20.00 mL,则该产品的纯度是__________。
②滴定过程中如果盛装标准液的滴定管没有润洗,则测得的结果将_______(填“偏高”或“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定量混合气体发生反应xA(g)+yB(g)![]() pC(g)+qD(g),平衡时测得B的浓度为1.0 mol·L-1。保持温度不变,将容器的体积压缩到原来的一半,再次达到平衡时,测得B的浓度为1.5 mol·L-1。下列有关判断正确的是
pC(g)+qD(g),平衡时测得B的浓度为1.0 mol·L-1。保持温度不变,将容器的体积压缩到原来的一半,再次达到平衡时,测得B的浓度为1.5 mol·L-1。下列有关判断正确的是
A.x+y<p+qB.气体的平均摩尔质量增大
C.压缩体积时,平衡向逆反应方向移动D.体系中混合气体的平均密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼锡的第一步反应原理为 2SnO2+3C![]() 2Sn+a M↑+CO2↑,则下列说法中错误的是
2Sn+a M↑+CO2↑,则下列说法中错误的是
A.a 的值为 2B.反应中 SnO2 被还原
C.每生成 1 mol M 转移电子 8 molD.反应后只有一种氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定由硝酸银和硝酸钠组成的混合物中硝酸银的含量,实验室可采用多种方法测定。现取两份不同质量的该混合物进行如下实验:
I.方法一:采用“佛尔哈德法”测定。“佛尔哈德法”可用于测定含银离子的硝酸溶液中银离子的含量,该方法是以铁铵钒[FeNH4(SO4)2·12H2O]为指示剂,NH4SCN溶液为标准溶液。从滴定开始到滴定终点,溶液中发生的主要反应有:
①Ag+(aq)+SCN-(aq)=AgSCN(s)(白色)
②Fe3++SCN-=Fe(SCN)2+(红色)
取14.0 g该混合物溶于蒸馏水配成500 mL待测溶液。取出25.00 mL待测溶液置于锥形瓶中,加入硝酸酸化,然后加水稀释至50 mL滴入指示剂铁铵钒溶液,用0.1000 mol·L-1的NH4SCN标准溶液滴定,消耗标准溶液35.00 mL。
(1)该滴定不能在中性或碱性条件下进行是因为Fe3+会转化为_________(填化学式,下同),Ag+会转化为___________。
(2)当滴入25.00 mL标准溶液时,锥形瓶中_________(填“有”或“没有”)沉淀生成。
(3)滴定终点溶液颜色的变化为________。
(4)称量混合物时,砝码生锈(锈迹未脱落)会导致测得的硝酸银的含量________(填“偏高”或“偏低”或“无影响”)。
(5)该混合物中硝酸银的质量分数为___________(保留三位有效数字)。
II.方法二:取m g该混合物溶于水配成500 mL溶液,取出50.00 mL溶液于锥形瓶中加入过量的稀盐酸充分反应,经“一系列操作”可得到纯净干燥的AgCl固体2.87 g。根据要求回答下列问题:
(6)“一系列操作”的具体步骤为__________、低温干燥。
(7)该混合物质量m=____________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源,下列说法不正确的是
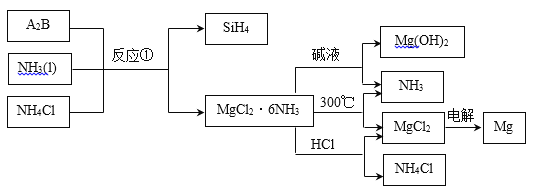
A.A2B的化学式为Mg2Si
B.该流程中可以循环使用的物质是NH3和NH4Cl
C.分别将MgCl2溶液和Mg(OH)2悬浊液加热,灼烧,最终得到的固体不同
D.MgCl2·6NH3所含部分元素的原子半径由小到大的顺序H<Cl<Mg
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com