
| 元素符号 | 电负性 | 元素符号 | 电负性 |
| Li | 0.98 | Be | 1.57 |
| B | 2.04 | C | 2.55 |
| O | 3.44 | F | 3.98 |
| Na | 0.93 | Al | 1.61 |
| Si | 1.90 | P | 2.19 |
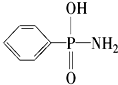 ,在P-N键中,你认为共用电子对偏向
,在P-N键中,你认为共用电子对偏向

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金刚石为空间网状结构,由共价键形成的碳原子环上,最小的环上有6个碳原子 |
| B、氯化钠晶体中,每个Na+周围距离相等的Na+共有6个 |
| C、氯化铯晶体中,每个Cs+周围紧邻8个Cl- |
| D、干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硬度很大、熔点很高 |
| B、高温下可分解气化 |
| C、良好的热稳定性 |
| D、较强的还原性,易燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、提高溶液碱性 | B、提高溶液酸性 |
| C、加水 | D、升温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.向FeCl3溶液中加入NaOH溶液,出现红褐色沉淀 |
| B、石膏点豆腐 |
| C、.一支钢笔使用两种不同牌号的墨水,易出现堵塞 |
| D、.江河入海处,易形成沙洲 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 方案 | 选用药品 | NaNO2溶液中的实验现象 | 利用NaNO2性质 |
| 方案1 | FeCl2和KSCN溶液 | ① | 氧化性 |
| 方案2 | ② | 溶液变蓝 | 氧化性 |
| 方案3 | FeCl3溶液 | ③ | 碱性 |
| 方案4 | 酸性KmnO4溶液 | 紫色溶液腿色 | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com