
【题目】溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图装置制取(该反应放出热量)。制取时观察到锥形瓶中导管口有白雾出现等现象。下列说法错误的是

A. 制备溴苯的反应属于取代反应
B. 装置图中长直玻璃导管仅起导气作用
C. 该反应还可能看到烧瓶中有红色蒸汽
D. 溴苯中溶有少量的溴,可用NaOH溶液洗涤除去
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。

(1)加热前通入氮气的目的是_____________,操作方法为____________ 。
(2)装置A、C、D中盛放的试剂分别为A_______,C________,D_______。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl的含量将_______(填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将________;
(4)若样品质量为wg,反应后C、D增加的质量分别为m1g、m2g,由此可知混合物中Na2CO3·10H2O的质量分数为_______(用含w、m1、m2的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇。一定条件下发生反应:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH<0。
CH3CH2OH(g)+3H2O(g) ΔH<0。
(1)在一定条件下,在20 L密闭容器中按物质的量比为1∶3充入CO2和H2,温度在450 K,n(H2)随时间变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 6 | 5 | 5 |
在450 ℃、0~1 min,v(CH3CH2OH)=________;此温度下该反应的化学平衡常数为________(结果保留三位有效数字)。
(2)在5 MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图所示:

曲线乙表示的是 ________(填物质的化学式)的体积分数,图像中A点对应的体积分数b=________%(结果保留三位有效数字)。
(3)下列措施中能使化学平衡向正反应方向移动的是________。
A.升高温度
B.将CH3CH2OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l mol CO2和3 mol H2
(4)25 ℃、1.01×105Pa时,9.2 g液态乙醇完全燃烧,当恢复到原状态时,放出273.4 kJ的热量,写出表示乙醇燃烧的热化学方程式:________________________。
(5)以石墨为电极,氢氧化钠、乙醇、水、氧气为原料,可以制成乙醇的燃料电池,写出发生还原反应的电极反应式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,工业上由铬铁矿(主要成分为FeOCr2O3、SiO2等)制备,制备流程如图所示:
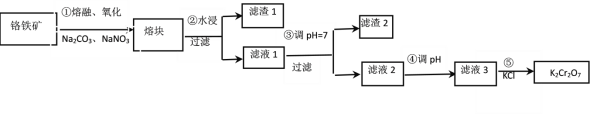
已知:a.步骤①的主要反应为:2FeOCr2O3+4Na2CO3+ 7NaNO3 ![]() 4Na2CrO4+Fe2O3+4CO2+7NaNO2,b. 2CrO42-+2H+
4Na2CrO4+Fe2O3+4CO2+7NaNO2,b. 2CrO42-+2H+ ![]() Cr2O72-+H2O,下列说法正确的是
Cr2O72-+H2O,下列说法正确的是
A. 步骤①熔融、氧化可以在陶瓷容器中进行
B. 步骤①中每生成44.8L CO2共转移7mol电子
C. 步骤④若调节滤液2的pH使之变小,则有利于生成Cr2O72—
D. 步骤⑤生成K2Cr2O7晶体,说明该温度下K2Cr2O7溶解度小于Na2Cr2O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应物中的原子全部转化为欲制的产物,即原子利用率为100%。下列反应最符合绿色化学中“原子经济”要求的是
A. nCH2=CH2![]()
![]()
B. CH4+2Cl2![]() CH2Cl2+2HCl
CH2Cl2+2HCl
C. Cl2+2NaOH===NaCl+NaClO+H2O
D. 3NO2+H2O===2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是 ( )


A. 用图1装置处理银器表面的黑斑(Ag2S),银器表面发生的反应为Ag2S+2e-=2Ag+S2-
B. 用图2装置电解一段时间后,铜电极部分溶解,溶液中铜离子的浓度基本不变
C. 图3装置中若直流电源的X极为负极,则该装置可实现粗铜的电解精炼
D. 图4装置中若M是铜,则该装置能防止铁被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),下列可以判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g),下列可以判断该分解反应已经达到化学平衡状态的是( )
A. 2v(NH3)=v(CO2) B. 密闭容器中总压强不变
C. 密闭容器中混合气体的平均摩尔质量不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) △H=xkJ·mol-l
已知:①C(s)+O2(g)=CO2(g) △H=akJ·mol-l
②K2S(s)=S(s)+2K(s) △H=bkJ·mol-l
③2K(s)+N2(g)+3O2(g)=2KNO3(s) △H=ckJ·mol-l
下列说法正确的是
A. x>0 a<0
B. b<0 c<0
C. x=3a-b-c
D. 1mol 碳(s)在空气中不完全燃烧生成CO的焓变小于akJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用所学知识,解决下列问题:
(1)AgNO3的水溶液呈______(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_____;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,目的是______。
(2)今有常温下五种溶液:NH4Cl溶液 CH3COONa溶液 (NH4)2SO4溶液 NH4HSO4溶液 NaOH溶液
①NH4Cl溶液的pH_____7(填“>”、“<”或“=”),升高温度可以_______(填“促进”或“抑制”)NH4Cl的水解;
②pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH_______NaOH溶液的pH(填“>”“=”或“<”);
③浓度相同的下列三种溶液:(A)NH4Cl溶液(B) (NH4)2SO4溶液(C)NH4HSO4 溶液,则c(NH4+)由大到小的顺序为____>___>____(用序号填空)。
(3)蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3·6H2O混合并加热,可得到无水AlCl3,试解释原因________。 (提示:SOCl2与水反应的化学方程式为SOCl2 +H2O= SO2↑+ 2HCl↑)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com